
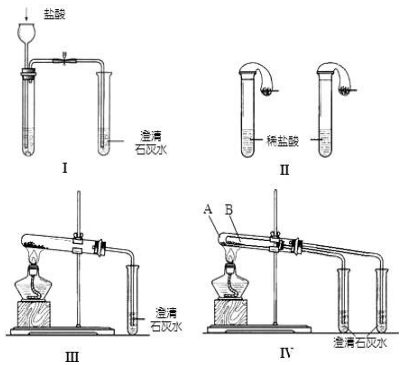
分析 (1)碳酸钠和碳酸氢钠均与盐酸反应气体,但生成气体的快慢及多少不同;
(2)图Ⅲ、Ⅳ中,均发生碳酸氢钠的分解生成二氧化碳,实验Ⅳ具有对比性;
(3)碳酸氢钠不稳定,加热易分解;开始加热时,压强增大,会产生气泡;
(4)①当石灰水过量时,反应生成碳酸钙、NaOH和水;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,反应生成碳酸钙、碳酸钠和水.
解答 解:(1)碳酸钠和碳酸氢钠均与盐酸反应气体,但生成气体的快慢及多少不同,图I不能判断,而图Ⅱ可观察气球变化鉴别,产生气体快的是碳酸氢钠,慢的是碳酸钠,
故答案为:Ⅱ;产生气体快的是碳酸氢钠,慢的是碳酸钠;
(2)图Ⅲ、Ⅳ中,均发生碳酸氢钠的分解生成二氧化碳,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑及CO2+Ca(OH)2=CaCO3↓+H2O,由图中装置及性质可知,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、CO2+Ca(OH)2=CaCO3↓+H2O; D;
(3)碳酸氢钠不稳定,加热易分解,则试管B中装入的固体最好是NaHCO3,碳酸钠在加热时不分解,之所以产生气泡,原因是装置中的空气热胀冷缩也会有气泡产生,
故答案为:NaHCO3;错误; 装置中的空气热胀冷缩也会有气泡产生;
(4)①当石灰水过量时,反应生成碳酸钙、NaOH和水,离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故答案为:HCO3-+OH-+Ca2+═CaCO3↓+H2O;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,反应生成碳酸钙、碳酸钠和水,所得溶液中溶质的化学式为Na2CO3,检验碳酸根离子,可取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-,
故答案为:Na2CO3;取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
点评 本题考查碳酸钠和碳酸氢钠的性质探究及鉴别,为高频考点,把握图中装置的作用及实验原理为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
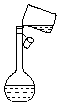 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涂改液危害人体健康、污染环境 | |
| B. | 中学生最好不用或慎用涂改液 | |
| C. | 苯的同系物和卤代烃皆可溶于水 | |
| D. | 苯的同系物和卤代烃是涂改液中的溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com