
【题目】pH均为9的CH3COONa溶液和KCN溶液,它们的物质的量浓度关系正确的是
A. c(CH3COONa) > c(KCN) B. c(CH3COONa) < c(KCN)
C. c(CH3COONa) = c(KCN) D. 无法确定
科目:高中化学 来源: 题型:
【题目】I.(1)比较原子半径的大小:O________F;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4_______H2SiO3
(3)稳定性:NH3________PH3
II.写出下列物质形成过程的电子式:
(4)HCl_________________________
(5)MgCl2 ______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1) 该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
; ; 。
(2) 该溶液中,浓度为0.01 mol/L的粒子是 ,浓度为0.002 mol/L的粒子是 。
(3) 和 两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学将钠,镁,铝各1mol分别投入到足量的盐酸中,预测实验结果:
(1)甲同学设计实验的目的是__________________________
(2)反应最剧烈的是______________
(3)将NaOH溶液与NH4Cl溶液混合生成NH3.H2O,从而验证NaOH的碱性强于NH3.H2O,继而验证Na的金属性大于N,你认为此设计是否合理?____________并说明理由:_____________.
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:
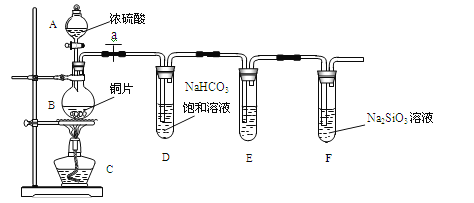
填写所示仪器名称A_________________B______________
(2)实验步骤: 连接仪器、____________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________;
②装置E中的试剂为_________________________,作用是______________________,反应方程式_____________________________________________;
③能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________
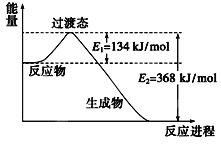
(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l)△H=+24.52kJ/mol
2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g)△H=+49.01kJ/mol
CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g)△H=-41.17kJ/mol
CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g)△H=+90.1kJ/mol
CO(g)+2H2(g)△H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
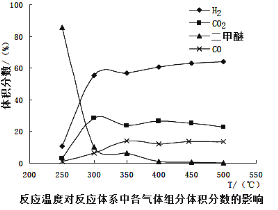
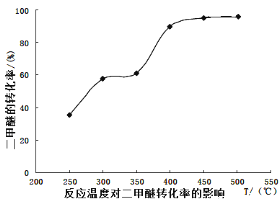
①你认为反应控制的最佳温度应为___________。
A.300~350℃B.350~400℃C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 ml 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )
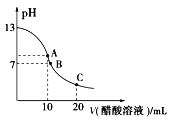
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(Na+)﹦c(CH3COO-)﹥c(OH-)﹦c(H+)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+)﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com