
| A. | 物质的量之比为2:1 | B. | 体积之比为1:2 | ||
| C. | 质量之比为16:7 | D. | 密度之比为7:16 |
科目:高中化学 来源: 题型:选择题
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→2H++SO42 | B. | Ba(OH)2→Ba2++(OH)2 | ||
| C. | FeCl3→Fe2++3Cl- | D. | NaHCO3→Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51.2% | B. | 36% | C. | 22% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
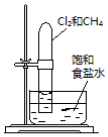 置于光亮处 置于光亮处 | 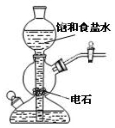 |
| A.验证甲烷与氯气发生化学反应 | B.实验室制乙炔 |
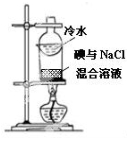 | 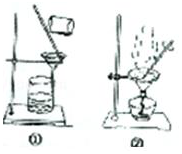 |
| C.从碘与氯化钠的混合溶液中分离碘 | D.粗苯甲酸的提纯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
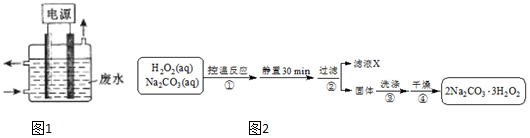
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com