
以下自发反应可用能量判据来解释的是( )
A.硝酸铵自发地溶于水
B.2N2O5(g)===4NO2(g)+O2(g)
ΔH=56.7 kJ·mol-1
C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)
ΔH=74.9 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l)
ΔH=-285.8 kJ·mol-1
科目:高中化学 来源: 题型:
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A、若a=b,则c(NH )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是
A.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
D.DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
A.该反应的正反应是吸热反应。
 B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C.T1时,当反应处于D点,则该反应的逆反应速率
大于正反应速率。
D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的
曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
1.下列说法正确的是( )
A.放热反应一定是自发进行的反应
B.吸热反应一定是非自发进行的反应
C.自发进行的反应一定容易发生
D.有些吸热反应也能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、101 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应的规律
(1)下列粒子既有氧化性又有还原性的是________。
①Fe2+ ②SO2 ③Fe ④Cl2 ⑤H2O2 ⑥HCl
⑦Fe3+ ⑧HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO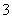 ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
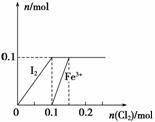
A.氧化性强弱:I2<Fe3+<IO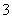
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I-+6Cl2===5I2+2Fe3++12Cl-
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I-+3Cl2===2I2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知醛或酮可与格氏试剂(R′MgX)发生加成反应,所得产物经水解可得醇:
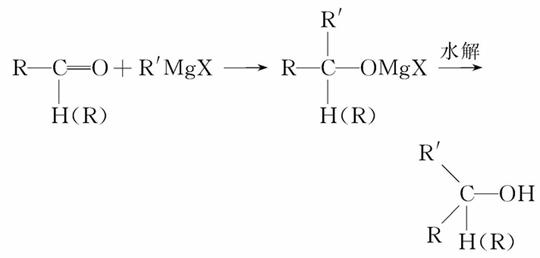
若用此种方法制取HOC(CH3)2CH2CH3,可选用的醛或酮与格氏试剂是( )
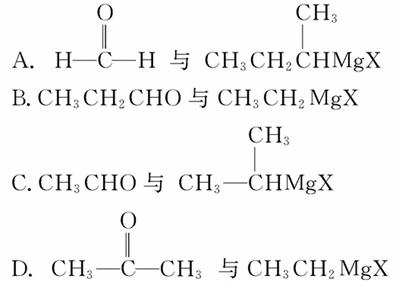
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com