
根据FeS2+O2―→Fe2O3+SO2回答下列问题
(1)氧化剂________,还原剂________,氧化产物________,还原产物________。
(2)元素化合价升高的元素为________,元素化合价降低的元素为________。
(3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。
(4)配平后各物质的系数依次为____________________。
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
下列各项中的“黄色”,不属于因化学反应而产生的是 ( )
A.将钠在石棉网上加热熔化,冷却后得到淡黄色固体
B.在氯化亚铁溶液中通入氯气,反应后得到黄色溶液
C.久置的碘化钾溶液呈黄色
D.食盐在无色的火焰上灼烧时,火焰呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
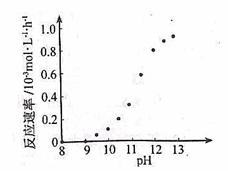 (1)电镀时,镀件与电源的 极连接。电镀铜时,电解质溶液应选用 (填化学式)。
(1)电镀时,镀件与电源的 极连接。电镀铜时,电解质溶液应选用 (填化学式)。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法 。
(3)酸浸法制取硫酸铜的流程示意图如下:
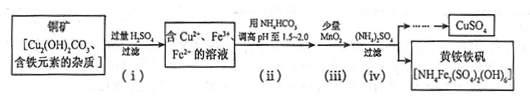
①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2mol电子,该反应的离子方程式为 ______。
④步骤(iv)除去杂质的化学方程式可表示为
3 Fe3+ + NH4+ + 2SO42- + 6H2O = NH4Fe 3 (SO4)2 (O H ) 6 ↓ + 6H+
过滤后母液的pH=2.0,c(Fe3+)=a mol·L-1,c(NH4+)=b mol·L-1,c(SO42-)=d mol·L-1,该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 ( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:
C2O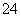 +____MnO
+____MnO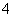 +____H+===____CO2↑+____Mn2++____H2O
+____H+===____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
则下列说法正确的是 ( )
A.该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物
B.充分反应后可以看到白色沉淀和气体生成
C.标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原
D.若有4 mol Na2O2参加反应,则反应中共转移6NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象、解释或结论正确的是 ( )
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在 | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
| B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
| C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com