
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
| 2x |
| (1-x)mol+3(1-x)mol+2xmol |
| n |
| V |
| ①+② |
| 2 |
| -574+△H2 |
| 2 |
| 2x |
| (1-x)mol+3(1-x)mol+2xmol |
| n |
| V |
| 0.6mol |
| 10L |
| 3(1-0.4)mol |
| 10L |
| 2×0.4mol |
| 10L |
| 0.08×0.08 |
| (0.18)3×0.06 |
| 0.08×0.08 |
| (0.18)3×0.06 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
| A、用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素 |
| B、焰色反应能用来鉴别所有金属元素 |
| C、用原子吸收光谱确定物质中含有哪些金属元素 |
| D、层析法利用了混合物中各物质被吸附性能的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
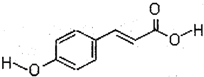 [化学一选修/有机化学基础]
[化学一选修/有机化学基础]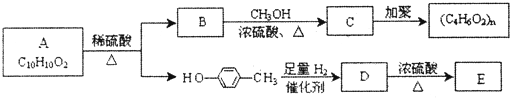
查看答案和解析>>
科目:高中化学 来源: 题型:
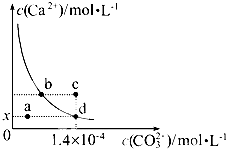 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2++SO42-═BaSO4↓ |
| B、Fe+2H+═Fe2++H2↑ |
| C、Al2O3+6H+═2Al3++3H2O |
| D、HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③②①④ |
| C、④③①② | D、③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检测糖尿病 |
查看答案和解析>>
科目:高中化学 来源: 题型:
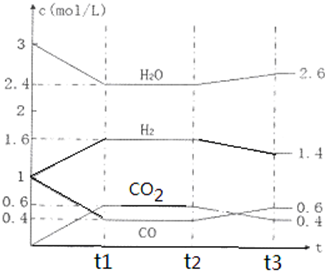

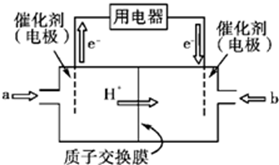
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com