
����Ŀ����ҩҩ����˪����Ҫ�ɷ�ΪAs2O3������ˮ�������������Ƽ���Ѫ������ҵ���ú����飨As2S3)�ķ���������˪�Ĺ���������ͼ��ʾ��
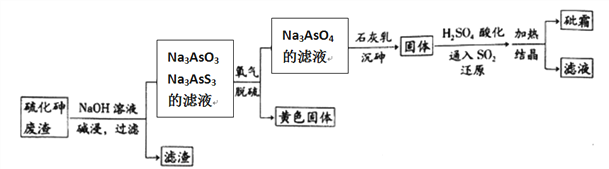
��1����������Ԫ�ػ��ϼ�Ϊ__________����������ˮ�����������������Ԫ�ؼ�̬���䣬��������Ҫ��Ӧ�����ӷ���ʽΪ________________________��
��2��������������б�������Ԫ����____________��
��3����ԭ������H3AsO4ת��ΪH3AsO3����Ӧ�Ļ�ѧ����ʽ��____________________��
��4��������������һ���¶��½���Ԫ��ת��ΪCa5(AsO4)3OH�����Ĺ��̣���Ҫ��Ӧ�У�
a.Ca(OH)2(S)![]() Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S)![]() 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
����ʯ�������Һ��c(OH-) =0.01mol L-1����ʱ��Һ��c(AsO43-) =________________��(��֪�� ![]() =2. 15)
=2. 15)
��5����ԭ�������Һ��H3AsO3�ֽ�ΪAs2O3���ᾧ�õ���As2O3��As2O3�ڲ�ͬ�¶ȺͲ�ͬŨ�������е��ܽ�ȶ�(S)��������ͼ��ʾ��
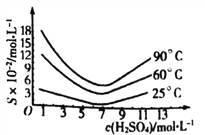
Ϊ����ߴ�As2O3�ij����ʣ����ᾧ�����̽��еIJ���������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ��ڴ˹�����Ӧ���Ƶ�����Ϊ_________________��
��6���ڹ�ҵ�����У����һ��������Һ��ѭ��ʹ�ã���Ŀ����____________________��
��7����Ԫ�ع㷺��������Ȼ�磬�����仯���ﱻ������ũҩ�����ݼ���ɱ����ȡ�
����ij�����������As2O3��As2O5������As2O5���ȶ��Բ����ͼ1д��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ___________________________________________��
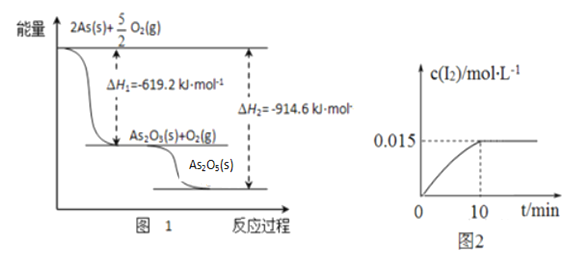
�������ƾ��������ԣ�298 Kʱ����100 mL�ձ��м���10 mL 0.1 mol/L Na3AsO4��Һ��20 mL 0.1 mol/L KI��Һ��20 mL 0.05 mol/L������Һ���������з�Ӧ��AsO43-(��ɫ)+2I-+2H+![]() AsO33-(��ɫ)+I2(dz��ɫ)+H2O �������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ����Һ����仯���Բ��ƣ���������������������淴Ӧ�ﵽƽ��״̬����_______������ĸ���ţ���
AsO33-(��ɫ)+I2(dz��ɫ)+H2O �������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ����Һ����仯���Բ��ƣ���������������������淴Ӧ�ﵽƽ��״̬����_______������ĸ���ţ���
a����Һ��ɫ���ֲ��ٱ仯 b��c(AsO33-)+c(AsO43-)���ٱ仯
c��AsO43-���������ʵ���I2���������� d�� ![]() ���ֲ��ٱ仯
���ֲ��ٱ仯
���𰸡� +3 As2S3+6OH- =AsO33-+AsS33-+3H2O As �� S SO2+H3AsO4+H2O=H3AsO3+H2SO4 2.15��10-8mol��L-1 ������Ũ��ԼΪ7 mol��L-1����ȴ���¶�Ϊ25�� �����Ļ����� As2O5(s)��As2O3(s)+O2(g ) ��H��+295.4 kJ/mol ac
��������(1).SԪ�صõ�����ʱ����-2�ۣ����ɼ��������Na3AsO3Ҳ�ɿ�����As��+3�ۣ���Ϊ�����������Ԫ�ؼ�̬���䣬������ͼ��֪����Na3AsO3��Na3AsS3�����ӷ���ʽΪ��As2S3+6OH- =AsO33-+AsS33-+3H2O��
(2).����������As������Ϊ+5�ۣ�SԪ�ر�����ΪS���ʣ����Ա�������Ԫ��ΪAs��S��
(3).��H3AsO4��SO2��ϣ�����H3AsO3��SO2���������䷴Ӧ����ʽΪ��SO2+H3AsO4+H2O=H3AsO3+H2SO4
(4).�ɷ�Ӧa��c(OH-) =0.01mol L-1��![]() ���ɷ�Ӧb�ɵ�
���ɷ�Ӧb�ɵ�![]() ��
��
(5).��ͼ2��֪��As2O3��25��C������Ũ��ԼΪ7mol/Lʱ���ܽ����С���ʡ��ᾧ������Ӧ��������Ũ��Ϊ7mol/L����ȴ���¶�25��C��
��6���ڹ�ҵ�����У����һ��������Һ��ѭ��ʹ�ÿ����As�Ļ����ʣ�
��7����As2O5���ȶ��Բ�ֽ�ΪAs2O3��O2��ͬʱ�ܾ߸�˹���ɿ�֪����H��|��H2|-|��H1|=914.6 kJ/mol-619.2 kJ/mol=+295.4 kJ/mol�����Ը÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��As2O5(s)��As2O3(s)+O2(g ) ��H��+295.4 kJ/mol��
��a.����Һ��ɫ����ʱ��I2�����������ı䣬��Ӧ�ﵽƽ�⣬a��ȷ��b.����ѧ��������ȣ���ֵ���淴Ӧ�仯���仯��b����c.������������ͬ��˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ�⣬c��ȷ��d.![]() Ϊ��ֵ�����ܷ�ӳ��Ӧ���ʵı仯��d����ѡ��ac��
Ϊ��ֵ�����ܷ�ӳ��Ӧ���ʵı仯��d����ѡ��ac��


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2 L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ��3A(g)+2B(g)![]() 4C(?)+2D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������1��6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����( )
4C(?)+2D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������1��6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����( )
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��![]()
B. ��ʱ��B��ƽ��ת������35��
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. ����C��B��ƽ��ת���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�������������±仯��ϵ��E�ǵ���ɫ��ĩ���жϣ�

��1��д��A��B��C��D��E��F�Ļ�ѧʽ��
A��__________��B��__________��C��__________��
D��__________��E��__________��F��__________��
��2��д���йط�Ӧ�Ļ�ѧ����ʽ(�����ӷ�Ӧ��ֱ��д�����ӷ���ʽ)
B �� C��__________________________________________________________________��
E �� B��___________________________________________________________________��
C �� F��___________________________________________________________________��
F �� C��___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к���NH4+��K+��Al3+��SO42���������ӣ���������ʵ�飺
��1��ȡ10 mL����Һ���Թ��в��μ�Ba(NO3)2��Һ����ϡ�����ữ����˵õ�0.03 mol��ɫ������
��2��ȡ10 mL����Һ���Թ��У��μ�NaOH��Һ������ɫ���������������ӵ�һ������ʼ��������(��Ҫʱ�ɼ���)����������ȫ�ܽ⡣������NaOH��Һ�ļ��룬����������ı仯��ϵ����ͼ��ʾ��

����˵����������ʵ���ǣ� ��
A. ����ͼ��ʾ���ݼ���ʵ����ʹ�õ�NaOH��Һ�����ʵ���Ũ��Ϊ1mol/L
B. ������Ϣ��������Һ����ɫ��Ӧ������ɫ�����ӵ����ʵ���Ũ��Ϊ1mol/L
C. ��ȡһ��������Һ�μ�һ������Ba(OH)2��Һ����ʹAl3+��SO42��ͬʱ��ȫ����
D. NH4+��K+��Al3+��SO42���������ӵ����ʵ���֮��Ϊ��2��1��1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
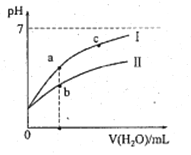
����Ŀ���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ�����±�ͼ���ʾ25��ʱ��ϡ��CH3COOH��HClO�������ϡ��Һ����ҺpH���ˮ���ı仯�������£��й�˵����ȷ����
����ĵ���ƽ�ⳣ��(25��) | |
CH3COOH | HClO |
Ka=1.8��10-5 | Ka=3.0��10-8 |
A. ͼ���У�a�������Ũ��>b�������Ũ��
B. ͼ���У�c(H+)��c(R-)��ֵ��a��>c��(HR����CH3COOH��HClO)
C. pH��ͬ��CH3COONa��Һ��NaClO��Һ��Ũ�ȹ�ϵ:c(CH3COOHNa)<c(NaClO)
D. ����ҺŨ����ȣ�CH3COONa��Һ��c(OH-)+c(CH3COO-)>NaClO��Һ��c(OH-)+c(C1O-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��̽����������ø����ø�ٷ�Ӧ����Ӱ���ʵ��װ��ͼ����ش��������⣺
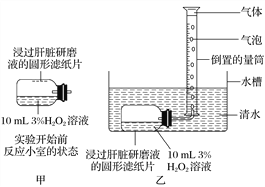
(1)��ʵ���ж��Ա����Ŀ��ƿ�ͨ��________________________��ʵ�֡������Ա�����������⣬��ʵ�����ر�����(�����Ҫ����)__________________��
(2)��Ҫ��֤ø��רһ�ԣ��ڴ�ʵ��װ�õĻ����ϣ�Ӧ��θĽ�(��д������Ĵ�ʩ)��
______________________________________________________________��
(3)�ܷ��ñ�ʵ��װ������֤�¶ȶ�ø���Ե�Ӱ�죿____________��ԭ����__________________________��
(4)�ڹ���������Һ��ͬŨ�ȡ���ͬ����IJ�ͬʵ�����м����С��ͬ��ͬ��Ŀ�Ľ���������ĥҺ����ֽƬ����ʵ�����������ɵ��������Ƿ���ͬ__________��ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�����X��Zͬ���壬Yԭ�ӵ�����������Ϊ������������һ�룬Xԭ�ӵ��������������������Ӳ�����3��������˵������ȷ����
A. �����̬�⻯������ȶ���,W>Z>Y B. ���ʵķе㣺Y>X>Z
C. �����Ӱ뾶:Z>W>X D. X���⻯���п��ܺ��зǼ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��Һ����ѧ��ѧ����ũҵ�����г�����һ���Լ���ijͬѧ����CuSO4��Һ����������ʵ��̽����

��1��ͼһ�Ǹ��ݷ�ӦZn + CuSO4 == Cu + ZnSO4 ��Ƴɵ�пͭԭ��ء�Cu���ĵ缫��Ӧʽ��________________________________________���������Ǻ���������KCl������Һ����ع���ʱK+��_______�ƶ�����ס����ҡ�����
��2��ͼ���У����Ǽ���ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľṹʾ��ͼ����ͬѧ���ڢ���ʵ�����϶�ͭ����b��ͨ�����________���CH4����O2������a���缫�Ϸ����ĵ缫��Ӧʽ��__________________________________________����ͭ�缫����������3.2g�������ĵ�CH4�ڱ�״���µ����Ϊ________________L��
��3��һ��ʱ���ȼ�ϵ�صĵ������Һ��ȫת��ΪK2CO3�����¹�ϵ��ȷ����______________��
A��c(K+)+c(H+)=c(HCO3��)+ c(CO32��)+c(OH��)
B��c(OH��)=c(H+)+c(HCO3��)+2c(H2CO3)
C��c(K+)>c(CO32��)>c(H+)>c(OH��)
D��c(K+)>c(CO32��)>c(OH��)>c(HCO3��)
E��c(K+)= 2c(CO32��)+ c(HCO3��)+c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ�����Ͻ�5.1g��ȫ����ϡ�����У��ڱ�״���¹��ռ�������5.6L�����㣺
��1�����������ʵ����� ��
��2��˫���ŷ���ʾ���������ᷴӦ�ĵ���ת�Ƶķ������Ŀ��
��3�������ֺϽ���þ���������ʵ����ֱ��Ƕ��٣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com