
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作或方法正确的是( )
A.用湿润的蓝色石蕊试纸检验![]()
B.烧碱属于离子化合物,熔点较高,实验室中可选用石英坩埚熔化烧碱
C.滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视滴定管中液面变化
D.用![]() 从碘水中萃取碘,有一步操作为“将分液漏斗倒转过来振荡,使两种液体充分接触”
从碘水中萃取碘,有一步操作为“将分液漏斗倒转过来振荡,使两种液体充分接触”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y= 或
或 ],与pH的变化关系如图所示。则下列说法一定错误的是( )
],与pH的变化关系如图所示。则下列说法一定错误的是( )

A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.直线Ⅱ中M、N点一定存在c2(HSO![]() )>c(SO
)>c(SO![]() )·c(H2SO3)
)·c(H2SO3)
D.当对应溶液的pH处于1.81<pH<6.91时,溶液中的一定存在:c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO3)
)>c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
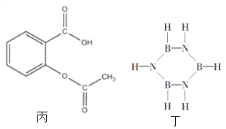
【题目】下列有关有机物结构和性质的说法正确的是( )
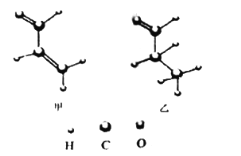
A. 甲中所有原子可能处于同一平面
B. 乙的一氯代物有4种
C. 丙一定条件下能发生的反应类型有取代,加成,氧化,消去反应
D. 丁与苯互为等电子体,可由苯的结构和性质推测丁的结构与性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
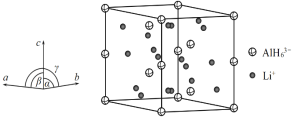
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
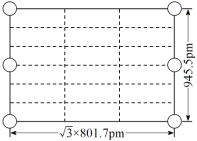
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,碘单质可与环戊烯![]() 反应生成环戊二烯
反应生成环戊二烯![]() :
:![]() 。现向1L密闭容器中加入
。现向1L密闭容器中加入![]() 和环戊烯
和环戊烯![]() 各
各![]() 使其发生上述反应,实验测得反应体系中
使其发生上述反应,实验测得反应体系中![]() 的物质的量
的物质的量![]() 随时间
随时间![]() 的变化如图所示,下列说法错误的是
的变化如图所示,下列说法错误的是

A.当环戊烯![]() 和环戊二烯
和环戊二烯![]() 的生成速率相等时,反应达到平衡
的生成速率相等时,反应达到平衡
B.![]() min内生成HI的反应速率
min内生成HI的反应速率![]()
![]()
C.10min时,环戊烯![]() 的转化率为
的转化率为![]()
D.![]() 后图线变化可能是反应体系温度升高所致
后图线变化可能是反应体系温度升高所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构简式如下图所示。下列关于有机物X的说法正确的是

A. X化学式为C8H6O6
B. X可发生加成反应、水解反应和氧化反应
C. X分子中所有的原子一定在同一平面内
D. X能使溴水和KMnO4溶液褪色,原因均与分子中碳碳双键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com