
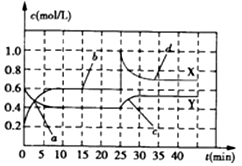
| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
分析 由图可知0-10min平衡状态时,X曲线△c=(0.6-0.2)mol/L=0.4mol/L,Y曲线△c=(0.6-0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)=$\frac{△c}{△t}$;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态.
解答 解:由图可知0-10min平衡状态时,X曲线△c=(0.6-0.2)mol/L=0.4mol/L,Y曲线△c=(0.6-0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),故A错误;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),故B正确;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,故C正确;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选A.
点评 本题考查图象分析及化学平衡计算,为高频考点,侧重考查学生分析、判断及计算能力,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响,明确图象中纵横坐标及点、线、面的意义,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
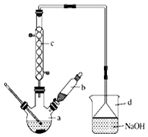 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
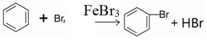 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)△H3S(s)+O2(g)=SO2(g)△H2,则△H1<△H2 | |
| B. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,则反应总能量>生成物总能量 | |
| C. | 己知C(石墨•s)=C(金刚石•s)△H>0,则石墨比金刚石稳定 | |
| D. | 相同条件下,如果1mol氢原子所具有的能量为E1•1mol氢分子所具有的能量为E2,则2E1=E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的转化率为60% | |
| B. | SO3的产率为60% | |
| C. | 平衡时总压强与起始压强之比为7:8 | |
| D. | 平衡时V(SO2):V(O2):V(SO3)=3:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com