
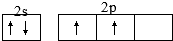
 ;所有电子云的伸展方向不能用化学用语表示,故选c;
;所有电子云的伸展方向不能用化学用语表示,故选c; ;c;C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”);
;c;C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”);| 3mol |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、越难失电子的元素得电子能力一定越强 |
| B、第三周期元素的最高正化合价等于它所处的主族序数 |
| C、溶于水可以导电的化合物一定是离子化合物 |
| D、离子化合物中可以含有共价键,共价化合物可以含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
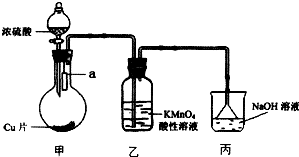 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| A- |
查看答案和解析>>
科目:高中化学 来源: 题型:
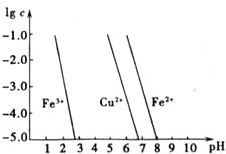 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食品加工,禁止使用化学添加剂 |
| B、食品包装,用聚乳酸材料替代聚乙烯 |
| C、蔬菜种植,禁止使用化肥和农药 |
| D、饮水处理,用高铁酸钾替代氯气和明矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com