
A”¢ŅŃÖŖ1 mol NO2ŗĶ1 mol CO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆČēĶ¼1£¬ŌņNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗNO2£Øg£©+CO£Øg£©=CO2£Øg£©+NO£Øg£©£»”÷H=+234kJ/mol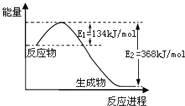 | ||||||||
B”¢Ņ»¶ØĪĀ¶ČĻĀ£¬ĄūÓĆpH¼Ę²ā¶Ø²»Ķ¬ÅØ¶Č“×ĖįČÜŅŗµÄpHÖµ£¬µĆµ½ČēĻĀŹż¾Ż£ŗ
| ||||||||
| C”¢ŅŃÖŖCaCO3µÄKsp=2.8”Į10-9£¬ĻÖ½«µČĢå»żµÄNa2CO3ČÜŅŗÓėCaBr2ČÜŅŗ»ģŗĻ£¬ČōCaBr2ČÜŅŗÅضČĪŖ 5.6”Į10-5 mol/L£¬ŌņÉś³É³ĮµķĖłŠčNa2CO3ČÜŅŗ×īŠ”ÅضČĪŖ 5”Į10-5 mol/L | ||||||||
D”¢ŌŚ²»Ķ¬Ģõ¼žĻĀ½ųŠŠµÄŅģ¹¹»Æ·“Ó¦ X?Y µÄ½ų³ĢĶ¼½āČēĻĀ£®Ķ¼2ÖŠµÄ”° ”±ŹĒX£¬”° ”±ŹĒX£¬”° ”±ŹĒY£¬ŌņæÉŅŌ¼ĘĖćµĆµ½ŅŅµÄĘ½ŗā³£ŹżK=1£¬ĒŅ±Č¼×µÄĘ½ŗā³£ŹżŅŖŠ” ”±ŹĒY£¬ŌņæÉŅŌ¼ĘĖćµĆµ½ŅŅµÄĘ½ŗā³£ŹżK=1£¬ĒŅ±Č¼×µÄĘ½ŗā³£ŹżŅŖŠ”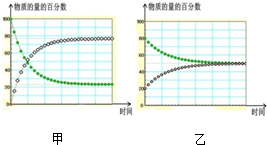 |
| 0.001mol/L |
| 0.1mol/L |
| 1 |
| 2 |
| 1 |
| 2 |


 ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢25”ꏱ£¬pH=4.75”¢ÅØ¶Č¾łĪŖ0.1mol?L-1µÄCH3COOH”¢CH3COONa»ģŗĻČÜŅŗ£ŗc£ØCH3COO-£©+c£ØOH-£©£¼c£ØCH3COOH£©+c£ØH+£© |
| B”¢0.01mol?L-1 NaHCO3ČÜŅŗ£ŗc£ØNa+£©£¾c£ØOH-£©£¾c£ØHCO3-£©£¾c£ØH+£© |
| C”¢Na2CO3ČÜŅŗ£ŗc£ØOH-£©-c£ØH+£©=c£ØHCO3-£©+c£ØH2CO3£© |
| D”¢ŹŅĪĀĻĀ£¬Ļņ0.01mol?L-1 NH4HSO4ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮÖŠŠŌ£ŗc£ØNa+£©£¾c£ØSO42-£©£¾c£ØNH4+£©£¾c£ØOH-£©=c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 1 |
| 2 |
| A”¢m+n£¾p |
| B”¢Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ |
| C”¢AµÄ×Ŗ»ÆĀŹĢįøß |
| D”¢CµÄĢå»ż·ÖŹżŌö¼Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| A”¢·“Ó¦¹ż³ĢaÓŠ“߻ƼĮ²ĪÓė |
| B”¢øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ČČŠ§Ó¦²»µČÓŚ”÷H |
| C”¢øıä“߻ƼĮ£¬æÉøıäøĆ·“Ó¦µÄ»ī»ÆÄÜ |
| D”¢ÓŠ“߻ƼĮĢõ¼žĻĀ£¬·“Ó¦µÄ»ī»ÆÄܵČÓŚE1+E2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢³£ĪĀ³£Ń¹ĻĀ£¬71g Cl2ÖŠŗ¬ÓŠµÄĀČŌ×ÓŹżÄæĪŖNA |
| B”¢±ź×¼×“æöĻĀ£¬0.1molCl2ČÜÓŚĖ®£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.1NA |
| C”¢46 g ÓÉNO2ÓėN2O4×é³ÉµÄ»ģŗĻĘųĢåŗ¬ÓŠµÄŌ×ÓŹżÄæĪŖ3NA |
| D”¢1 L 0.1 mol?L-1FeCl3ČÜŅŗÖŠŗ¬ÓŠµÄFe3+Ąė×ÓŹżÄæĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ŹÆÓĶĮŃ½āµĆµ½µÄĘūÓĶŹĒ“æ¾»Īļ |
| B”¢ŹÆÓĶ²śĘ·¶¼æÉÓĆÓŚ¾ŪŗĻ·“Ó¦ |
| C”¢Ė®ĆŗĘųŹĒĶعżĆŗµÄŅŗ»ÆµĆµ½µÄĘųĢåČ¼ĮĻ |
| D”¢ĢģČ»ĘųŹĒŅ»ÖÖĒå½ąµÄ»ÆŹÆČ¼ĮĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢NO2ĶØČėFeSO4ČÜŅŗÖŠ |
| B”¢CO2ĶØČėCaCl2ČÜŅŗÖŠ |
| C”¢NH3ĶØČėAlCl3ČÜŅŗÖŠ |
| D”¢SO2ĶØČėĖįŠŌKMnO4ČÜŅŗÖŠ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com