
| A. | y=x%<$\frac{1}{2}$ | B. | y=1-x%>$\frac{2}{3}$ | C. | y=x%>$\frac{1}{3}$ | D. | y=1-2x%>$\frac{1}{3}$ |
分析 1,3丁二烯在1升混和气体中的体积分数为x%,即1,3丁二烯为x%L,则氢气为(1-x%)L,发生反应:C4H6+2H2→C4H10,由方程式可知,若恰好反应时:减少体积=V(C2H4)=(H2);若1,3丁二烯过量,则:减少体积=V(H2),剩余气体体积=V(1,3丁二烯);若氢气过量,则:减少体积=V(1,3丁二烯),剩余气体体积=V(H2),据此讨论计算.
解答 解:1,3丁二烯在1升混和气体中的体积分数为x%,即1,3丁二烯为x%L,则氢气为(1-x%)L,发生反应:C4H6+2H2→C4H10,由方程式可知,若恰好反应时:减少体积=V(C2H4)=(H2);若1,3丁二烯过量,则:减少体积=V(H2),剩余气体体积=V(1,3丁二烯),所以y=x%>$\frac{1}{3}$;若氢气过量,则:减少体积=V(1,3丁二烯),剩余气体体积=V(H2),所以y=1-x%>$\frac{2}{3}$,
故选BC.
点评 本题考查混合物计算,难度中等,注意根据方程式分情况讨论计算解答.


科目:高中化学 来源: 题型:解答题
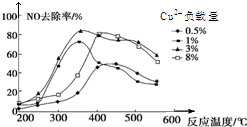 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
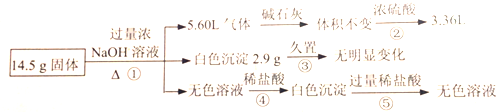
| A. | 含4.5gAl | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 含有物质的量相等的(NH4)2SO4和MgCl2 | |
| D. | 含有MgCl2和FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在NaOH热溶液中完全水解后,加入热饱和食盐水可观察到液面上有固体析出 | |
| B. | 容量瓶、滴定管和分液漏斗均标有“O”刻度线,使用前均需要检漏 | |
| C. | 实验室用二氧化锰与浓盐酸制氯气时,先加热二氧化锰再滴加浓盐酸 | |
| D. | 为检验摩尔盐中的NH4+,可向试样加入少量的稀Na0H,再用pH试纸检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
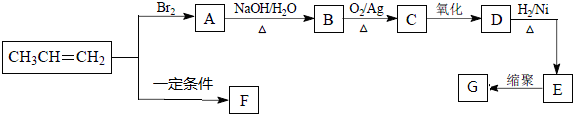
 .
. ,该反应类型是加聚反应.
,该反应类型是加聚反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com