
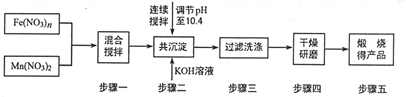
 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).分析 (1)根据MnFe2O4的制备流程,可知Mn、Fe的化合价未变,Mn(NO3)2中Mn的化合价为+2,则MnFe2O4中Fe的化合价为+3,从而求出Fe(NO3)n中的n;
(2)根据搅拌的通常目的和判断沉淀是否洗涤干净的方法来解答,Fe3+和Mn2+在碱性条件下生成沉淀;
(3)原先溶液呈碱性;
(4)①根据铁的总价态不变,用方程组来解决;
②③由流程可看出其优点,改进方法可从流程简洁方面考虑.
解答 解:(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3,且Fe(NO3)n与Mn(NO3)2 二者之比 2:1,故答案为:3;
(2)连续搅拌是为了让二者充分反应,Fe3+和Mn2+在碱性条件下生成沉淀,离子方程式:Fe3++3OH-=2Fe(OH)3↓;Mn2++2OH-=Mn(OH)2↓,故答案为:充分反应或沉淀完全;Fe3++3OH-=2Fe(OH)3↓;Mn2++2OH-=Mn(OH)2↓;
(3)原先溶液呈碱性,取最后一次洗涤液少许,测洗下来的溶液呈中性,故答案为:取最后一次洗涤液少许,测洗下来的溶液呈中性;
(4)①x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有
x+y=2
2x+3y=4.8
解得:x=1.2,y=0.8,
则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.2 mol,则Fe2+占的百分率为$\frac{1.2}{2}$×100%=60%,Fe3+占全部铁元素的百分率为40%,故答案为:40%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等,
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等(答两点即可);
③因高温消耗较多的能源,则寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物,故答案为:寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物.
点评 本题以MnFe2O4的制备为载体,考查学生对工艺流程的理解、对实验操作的理解、化学式有关计算等,难度中等,综合性较强,涉及的知识点多,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2+H2O═H2SO3 | B. | SO2+2NaOH═Na2SO3+H2O | ||
| C. | 2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3 | D. | SO2+2H2S═3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮族元素和硼族元素在生产生活中有很重要的地位.
氮族元素和硼族元素在生产生活中有很重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑤⑥ | C. | ③④ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com