
 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:

 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. +(CH3)2CHCH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2OH$→_{△}^{浓硫酸}$ +H2O,反应类型为酯化反应或取代反应.
+H2O,反应类型为酯化反应或取代反应.分析 A的不饱和度为$\frac{2×7+2-8}{2}$=4,A经过系列转化合成肉桂酸异戊酯G( ),则A含苯环,可推知A为
),则A含苯环,可推知A为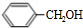 ,则B为
,则B为 ,根据信息可得B、C反应为两醛缩合,结合G的结构可判断出用到了乙醛,即C为CH3CHO,则D为
,根据信息可得B、C反应为两醛缩合,结合G的结构可判断出用到了乙醛,即C为CH3CHO,则D为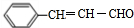 ,E为
,E为 ,F为(CH3)2CHCH2OH;
,F为(CH3)2CHCH2OH;
(4)(CH3)2CHCH2OH的同分异构体不能与金属钠反应,只能是醚.醚的异构体以氧原子为分界:①左1个碳右3个碳(丙基),丙基有2种异构,则醚有2种异构体,②左2个碳右2个碳(均为乙基),醚有1种异构体,故共3种,
其中一种同分异构体H的核磁共振氢谱只有两组峰,且峰面积比为3:2,则H为CH3CH2OCH2CH3,此种物质可经过流程:C$→_{H_{2}}^{催化剂}$Ⅰ$→_{140℃}^{浓H_{2}SO_{4}}$H制得,I为CH3CH2OH;
(5)E为 ,符合下列条件①属于芳香族化合物;②1mol E与足量新制银氨溶液反应,生成4mol Ag,说明E中有两个醛基,这样的E的同分异构体可以是苯上连有两个-CHO、一个CH3,这样有6种结构,也可以是-CH2CHO、-CHO两个基团,这样的结构有邻间对三种;也可以是苯环上连有-CH(CHO)2.
,符合下列条件①属于芳香族化合物;②1mol E与足量新制银氨溶液反应,生成4mol Ag,说明E中有两个醛基,这样的E的同分异构体可以是苯上连有两个-CHO、一个CH3,这样有6种结构,也可以是-CH2CHO、-CHO两个基团,这样的结构有邻间对三种;也可以是苯环上连有-CH(CHO)2.
解答 解:A的不饱和度为$\frac{2×7+2-8}{2}$=4,A经过系列转化合成肉桂酸异戊酯G( ),则A含苯环,可推知A为
),则A含苯环,可推知A为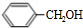 ,则B为
,则B为 ,根据信息可得B、C反应为两醛缩合,结合G的结构可判断出用到了乙醛,即C为CH3CHO,则D为
,根据信息可得B、C反应为两醛缩合,结合G的结构可判断出用到了乙醛,即C为CH3CHO,则D为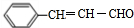 ,E为
,E为 ,F为(CH3)2CHCH2OH,
,F为(CH3)2CHCH2OH,
(1)由上述分析可知,A为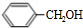 ,名称为苯甲醇,含有官能团为羟基,故答案为:苯甲醇;羟基;
,名称为苯甲醇,含有官能团为羟基,故答案为:苯甲醇;羟基;
(2)B能与新制的Cu(OH)2悬浊液发生反应,该反应的化学方程式为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(3))E和F反应生成G的化学方程式为: +(CH3)2CHCH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2OH$→_{△}^{浓硫酸}$ +H2O,属于酯化反应或取代反应,
+H2O,属于酯化反应或取代反应,
故答案为: +(CH3)2CHCH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2OH$→_{△}^{浓硫酸}$ +H2O;酯化反应或取代反应;
+H2O;酯化反应或取代反应;
(4)(CH3)2CHCH2OH的同分异构体不能与金属钠反应,只能是醚.醚的异构体以氧原子为分界:①左1个碳右3个碳(丙基),丙基有2种异构,则醚有2种异构体,②左2个碳右2个碳(均为乙基),醚有1种异构体,故共3种,
其中一种同分异构体H的核磁共振氢谱只有两组峰,且峰面积比为3:2,则H为CH3CH2OCH2CH3,此种物质可经过流程:C$→_{H_{2}}^{催化剂}$Ⅰ$→_{140℃}^{浓H_{2}SO_{4}}$H制得,I为CH3CH2OH,
则I生成H反应的化学方程式:2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,
故答案为:3;2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O;
(5)E为 ,符合下列条件①属于芳香族化合物;②1mol E与足量新制银氨溶液反应,生成4mol Ag,说明E中有两个醛基,这样的E的同分异构体可以是苯上连有两个-CHO、一个CH3,这样有6种结构,也可以是-CH2CHO、-CHO两个基团,这样的结构有邻间对三种;也可以是苯环上连有-CH(CHO)2,所以共有10 种(不包含E),
,符合下列条件①属于芳香族化合物;②1mol E与足量新制银氨溶液反应,生成4mol Ag,说明E中有两个醛基,这样的E的同分异构体可以是苯上连有两个-CHO、一个CH3,这样有6种结构,也可以是-CH2CHO、-CHO两个基团,这样的结构有邻间对三种;也可以是苯环上连有-CH(CHO)2,所以共有10 种(不包含E),
故答案为:10.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合应用能力,根据A、G关系为突破口采用正逆结合的方法进行推断,难点是(5)题同分异构体种类判断.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)>c(SO32-)>c(HSO3-) | |
| B. | c(Na+)>c(HCO3-)>c(CO32-)>c(SO32-)>c(OH-)>c(H+) | |
| C. | c(Na+)>[c(HCO3-)+c(CO32-)+c(H2CO3)+c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(HSO3-)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 某物质的溶液pH<7,则该物质一定是酸 | |
| C. | pH=7的某溶液一定呈中性 | |
| D. | pH=7.6的氨水,c(H+)>10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物  的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| D. | 一分子β-月桂烯( )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com