
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体 | HA放出氢气的反应速率更快 | 酸性:HB<HA |
| B | 以铜、铁、浓硝酸构成原电池 | 铁表面有红棕色气泡产生 | 铜作原电池的负极 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCls饱和溶液 | 前者为黄色,后者为红褐色 | 升高温度,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中 | 一段时间后,检验固体主要成分为CaCO3 | Ksp ( CaSO4)<Ksp ( CaCO3 ) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓度相同时HA放出氢气的反应速率更快,则HA的酸性强;
B.铜与浓硝酸反应,而铁与浓硝酸在常温下发生钝化现象;
C.盐的水解为吸热反应,升高温度后水解程度增大;
D.溶度积越小,难溶物溶解度越小.
解答 解:A.等体积等浓度的HA和HB两种酸分别与足量的锌反应,HA放出氢气的反应速率更快,说明HA的酸性较强,即酸性:HB<HA,故A不选;
B.Fe在常温下与浓硝酸发生钝化,阻止了反应的继续进行,则以铜、铁、浓硝酸构成原电池,Cu为负极,Fe为正极,正极硝酸根离子得到电子生成红棕色的二氧化氮,故B不选;
C.向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色,说明在沸水中铁离子的水解程度较大,据此可知升高温度,Fe3+的水解程度增大,故C不选;
D.水垢中的CaSO4用Na2CO3溶液充分浸泡后可转化为CaCO3,说明溶解度CaSO4>CaCO3,故D选;
故选D.
点评 本题考查化学实验方案的评价,题目难度中等,涉及酸性强弱比较、原电池原理、难溶物溶度积大小判断、盐的水解原理等知识,明确难溶物溶解度与溶度积的关系为解答关键,B为易错点,注意铁在常温下与浓硝酸发生钝化现象,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
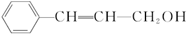 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: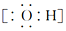 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Se的原子序数为 24 | |
| B. | Se的氢化物的还原性比硫化氢气体强 | |
| C. | Se的非金属性比Br强 | |
| D. | Se的最高价氧化物分子式为:SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com