
 ;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.
;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.分析 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,元素其中B与C同周期,D与E和F同周期,C与F同主族,D是所在周期原子半径最大的主族,D为Na元素,A与D同主族,且A的原子序数最小,结合A与其它元素不在同周期,可知A为H;F元素的原子最外层电子数是电子层数的二倍,F应为第三周期元素,则最外层电子数为6,即F为S,可知C为O;又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,D、F的单质为固体,则E可能为Al或Si,B为N符合,以此来解答.
解答 解:由上述分析可知,A为H,B为N,C为O,D为Na,E为Al或Si,F为S,
(1)元素F在周期表中的位置是第3周期第ⅥA族,故答案为:第3周期第ⅥA族;
(2)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则C、D、F三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+,
故答案为:S2->O2->Na+;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,所含化学键类型有离子键、共价键(极性共价键、配位键),
故答案为:离子键、共价键;
(4)由A、B两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,Y为N2H4,其的电子式为 ,3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,可知1molY反应时放出热量为$\frac{Q}{\frac{3.2}{32}}$=10kJ,则热化学反应方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10 Q kJ/mol,
,3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,可知1molY反应时放出热量为$\frac{Q}{\frac{3.2}{32}}$=10kJ,则热化学反应方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10 Q kJ/mol,
故答案为: ;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10 Q kJ/mol;
;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10 Q kJ/mol;
(5)E是金属元素,则E为Al,其单质与氧化铁反应常用于焊接钢轨,反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;E是非金属元素,E为Si,其氧化物溶于强碱溶液的离子方程式SiO2+2OH-=SiO32-+H2O,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;SiO2+2OH-=SiO32-+H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构、原子序数来推断元素为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
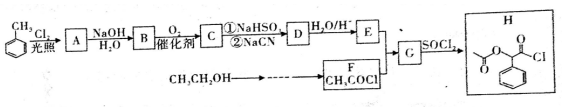

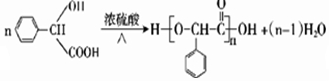 .
.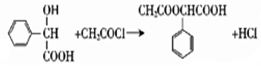 .
.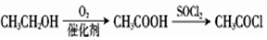 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com