
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
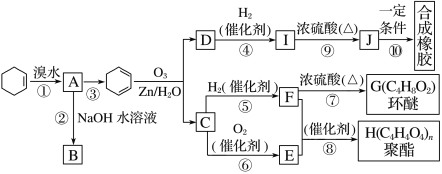
已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反应条件是_________________________________________________。
(2)A的名称是_______________________________________________。
(3)有机物B和I的关系为________(填字母)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑩中属于取代反应的________________________________________。
(5)写出反应⑩的化学方程式____________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:_____________。
【答案】NaOH醇溶液、加热 1,2-二溴环己烷 C ②、⑦、⑧ nCH2=CH—CH=CH2![]()
![]() CH2=CHCOOCH3、HCOOCH2CH=CH2
CH2=CHCOOCH3、HCOOCH2CH=CH2
【解析】
利用题目所给信息,正向分析与逆向分析结合,可知
 。
。
根据以上分析,(1)反应③是![]() 发生消去反应生成
发生消去反应生成![]() ,反应条件是NaOH醇溶液、加热。
,反应条件是NaOH醇溶液、加热。
(2)A是![]() ,名称是1,2-二溴环己烷。
,名称是1,2-二溴环己烷。
(3)有机物B是![]() 、I是
、I是![]() ,结构不同,不属于同系物;分子式不同,不是同分异构体;都含有羟基,都属于醇类;含有氧元素,不属于烃,故选C。
,结构不同,不属于同系物;分子式不同,不是同分异构体;都含有羟基,都属于醇类;含有氧元素,不属于烃,故选C。
(4)反应①是加成反应;②是羟基代替溴原子,属于取代反应;③是![]() 生成
生成![]() ,属于消去反应;④是
,属于消去反应;④是![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ;⑤是
;⑤是![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ;⑥是
;⑥是![]() 发生氧化反应生成
发生氧化反应生成![]() ;⑦是2分子
;⑦是2分子![]() 发生取代反应生成
发生取代反应生成 ;⑧是
;⑧是![]() 与
与![]() 发生取代反应生成聚酯
发生取代反应生成聚酯![]() ;⑨是
;⑨是![]() 发生消去反应生成
发生消去反应生成![]() ;⑩是
;⑩是![]() 发生加聚反应生成
发生加聚反应生成![]() ,属于取代反应的是②、⑦、⑧。
,属于取代反应的是②、⑦、⑧。
(5)反应⑩是![]() 发生加聚反应生成
发生加聚反应生成![]() ,化学方程式是nCH2=CH—CH=CH2
,化学方程式是nCH2=CH—CH=CH2![]()
![]() 。
。
(6) ![]() 的不饱和度是2,属于酯类的链状同分异构体应该含有1个碳碳双键,结构简式有CH2=CHCOOCH3、HCOOCH2CH=CH2。
的不饱和度是2,属于酯类的链状同分异构体应该含有1个碳碳双键,结构简式有CH2=CHCOOCH3、HCOOCH2CH=CH2。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满N2重114g,若充满CO2重122g,现充满某气体重108g,则某气体的相对分子质量为
A.28B.32C.44D.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化:

(1)写出反应③的化学方程式:_____________________________________________。写出反应④的离子方程式:_____________________________________________。
(2)在操作②中所使用的玻璃仪器的名称是:____________________________。
(3)下列实验装置中可用于实验室制取气体G的发生装置是______;(用字母表示)为了得到纯净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂_____,d装置中存放的试剂______。



(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式:____________________________。
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是____________。

Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。

(1)装置③中发生反应的化学方程式为________________________________________
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。
反应原理为3ClO-+I-===3Cl-+IO3- IO3-+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。该漂白粉中有效成分的质量分数为________________。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:

(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,除需加硫酸外还需要加少量铁屑的目的是________。
(2)加热至沸腾生成沉淀时反应的化学方程式为________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有________(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为________。
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
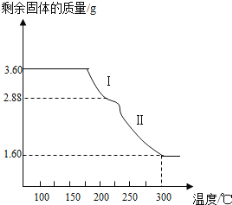
①过程Ⅰ发生反应的化学方程式为________________________。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式___________(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
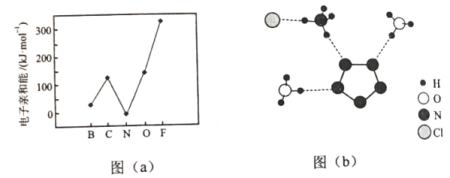
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
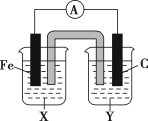
请回答下列问题:
①电解质溶液X是___;电解质溶液Y是___。
②写出两电极的电极反应式:铁电极:_;碳电极:__。
③外电路中的电子是从__电极流向__电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是__(填字母):A.K+ B.NO3-
(2)请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。
①原电池装置图:_______;
②正极:_________;
③负极:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过计算回答下列问题:
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱溶液,实验结束后,称得浓硫酸质量增加9g,浓碱溶液质量增加17.6g。该烃的化学式为_____,并写出其所有可能的结构简式:____。
(2)某链状烷烃的相对分子质量为128,该烷烃的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.2g重水(D2O)中含有的中子数是0.1mol
B.0.1molF-中含有的电子数大于6.02×1023
C.1mol1H216O2中的中子数是1mol1H216O中的中子数的2倍
D.ag![]() S原子所含电子数
S原子所含电子数![]() NA
NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com