
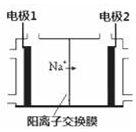
 ��ⱥ��ʳ��ˮ����Ҫ�Ļ�����ҵ��������Ϊ���ȼҵ�����ڽ̲ġ���ѧ1��������ѧ2��������ѧ��Ӧԭ�����о����ἰ����д����ⱥ��ʳ��ˮ�Ļ�ѧ��Ӧ����ʽ2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2��������ͼ2�ǡ���ѧ��Ӧԭ�����е�ⱥ��ʳ��ˮ��ҵ�������õ����ӽ���Ĥ����ʾ��ͼ������ͼ�������ѱ���ȥ�������ͼ�в�������Ϣ��ͨ���Ժ�Na+���Ҳ��ƶ������жϳ��缫2 ���������ڸõ缫��Χ����Һ�У�NaOHŨ�Ƚ���������С�����䡱�����缫1�ϵĵ缫��ӦʽΪ2Cl--2e-=Cl2����
��ⱥ��ʳ��ˮ����Ҫ�Ļ�����ҵ��������Ϊ���ȼҵ�����ڽ̲ġ���ѧ1��������ѧ2��������ѧ��Ӧԭ�����о����ἰ����д����ⱥ��ʳ��ˮ�Ļ�ѧ��Ӧ����ʽ2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2��������ͼ2�ǡ���ѧ��Ӧԭ�����е�ⱥ��ʳ��ˮ��ҵ�������õ����ӽ���Ĥ����ʾ��ͼ������ͼ�������ѱ���ȥ�������ͼ�в�������Ϣ��ͨ���Ժ�Na+���Ҳ��ƶ������жϳ��缫2 ���������ڸõ缫��Χ����Һ�У�NaOHŨ�Ƚ���������С�����䡱�����缫1�ϵĵ缫��ӦʽΪ2Cl--2e-=Cl2���� ���� ���ԭ������Ȼ�����Һ�õ��������ơ����������������ݵ��װ��������������������缫2Ϊ���������Ե缫1Ϊ������ʧ���ӷ���������Ӧ���ݴ˷�����
��� �⣺��ⱥ��ʳ��ˮ�������������ӵõ�������������������������ʧ�����������������ⷽ��ʽΪ��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2�������װ����������������������缫2Ϊ���������Ե缫1Ϊ������������������ʧ������������ͬʱ�������������ӣ����������缫��Χ����Һ�У�NaOHŨ�Ƚ�����������������ʧ����������������ӦʽΪ2Cl--2e-=Cl2����
�ʴ�Ϊ��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2�����������2Cl--2e-=Cl2����
���� ���⿼���˵��ԭ����Ӧ�ã����ؿ�������е缫���жϺ͵缫����ʽ����д��ע��֪ʶ�������ջ����ǹؼ�����Ŀ�ѶȲ�����Ŀ����������ѧ���ķ��������ͶԻ���֪ʶ��Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӵ��������� | B�� | ��С����Ũ�� | C�� | ����ʯ��ʯ | D�� | ������ϵѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  3-��-2-�һ����� 3-��-2-�һ����� | |
| B�� | ��CH3��3CCH2CH��C2H5��CH3 2��2-����-4-�һ����� | |
| C�� | 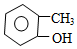 �ڼ����� �ڼ����� | |
| D�� |  2-��-3-��Ȳ 2-��-3-��Ȳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �����ʵ���Ũ����ͬ�� �ٰ�ˮ ���Ȼ�� ��̼����� ��������� ������� ������Һ��c��NH4+����С��˳���ǣ�����ţ��ݣ��ܣ��ڣ��ۣ���
�����ʵ���Ũ����ͬ�� �ٰ�ˮ ���Ȼ�� ��̼����� ��������� ������� ������Һ��c��NH4+����С��˳���ǣ�����ţ��ݣ��ܣ��ڣ��ۣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ת����Һ | B�� | 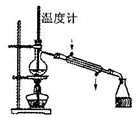 ������ˮ ������ˮ | C�� | 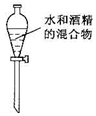 ����ˮ�Ⱦƾ� | D�� | 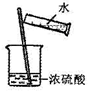 ϡ��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪ij���淴Ӧ���ܱ������н��У�A��g��+2B��g��?3C��g��+D��s�������ȷ�Ӧ����ͼ������b����һ�������¸÷�Ӧ�Ĺ��̣���ʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ�ǣ�������
��֪ij���淴Ӧ���ܱ������н��У�A��g��+2B��g��?3C��g��+D��s�������ȷ�Ӧ����ͼ������b����һ�������¸÷�Ӧ�Ĺ��̣���ʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ�ǣ�������| A�� | ����A��Ũ�� | B�� | ����C��Ũ�� | C�� | ������� | D�� | �����¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʱ������Ҫ���ϸɾ��ij���ֽ | |
| B�� | ��Һʱ�����в���Һ�彦���������������ҺŨ��ƫС | |
| C�� | ����ʱ��������ƿ�̶��ߣ������������ҺŨ��ƫ�� | |
| D�� | ����ҡ�Ⱥ���Һ���½�����Ӧ�ټ�����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com