
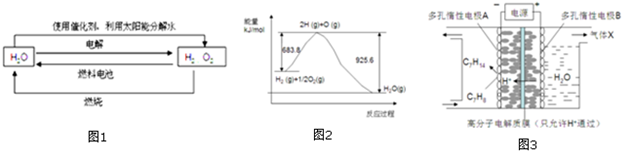
分析 (1)根据如图1中4个过程中能量转化形式分析;
(2)根据焓变只与反应物和生成物的状态及其系数有关来分析;
(3)由图象可知H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=683.8-925.6=-241.8kJ•mol-1,结合H2O(l)=H2O(g)△H=+44kJ•mol-1利用盖斯定律进行计算;
(4)①NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,结合转移电子守恒配平方程式;
②根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
③该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2;电极A上发生的反应C7H8得电子和氢离子生成C7H14.
解答 解:(1)由如图1中4个过程,则能量转化形式有太阳能转化成电能,电能与化学能之间的转化,化学能转化成热能,光能等,所以4个过程中能量转化形式有4种以上,故选:D;
(2)因为焓变只与反应物和生成物的状态及其系数有关,所以2H2O(1)$\frac{\underline{\;通电\;}}{\;}$2H2(g)+O2(g)△H1 2H2O(1)$\frac{\underline{\;\;\;光照\;\;\;}}{催化剂}$2H2(g)+O2(g)△H2,反应物生成物完全相同,所以△H1=△H2;
故答案为:=;
(3)由图象可知①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=683.8-925.6=-241.8kJ•mol-1,
已知②H2O(l)=H2O(g)△H=+44kJ•mol-1,
利用盖斯定律将①×2-②×2可知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,
故答案为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1;
(4)①NaBH4与水发生氧化还原反应生成NaBO2和H2,化学方程式为:NaBH4+2H2O=NaBO2+4H2↑;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;
②欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;故答案为:升高温度或降低压强;
③该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2;电极A上发生的反应C7H8得电子和氢离子生成C7H14,反应式为 C7H8+6H++6e-═C7H14;故答案为:O2;C7H8+6H++6e-═C7H14.
点评 本题考查了盖斯定律的应用、化学平衡及其电解池原理等知识点,根据化学平衡移动原理、电解原理等知识点来分析解答,难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 除去蛋白质溶液中的NaCl而不改变它的性质,可加入适量的AgNO3溶液,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
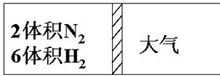 在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | Na2S2O3溶液的体积和浓度 | H2SO4溶液的体积和浓度 | |
| A | 50℃ | 5mL 0.5mol•L-1 | 5mL 0.5mol•L-1 |
| B | 50℃ | 50mL 0.1mol•L-1 | 50mL 0.1mol•L-1 |
| C | 50℃ | 10mL 0.2mol•L-1 | 10mL 0.2mol•L-1 |
| D | 50℃ | 15mL 0.1mol•L-1 | 15mL 0.1mol•L-1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A和C形成一种化合物CA,则CA属于离子化合物 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | 由于化合物A2B形成氢键,所以热稳定性:A2B>A2D | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在共价化合物中一定含有共价键 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非金属原子间只能形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(ClO)2中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 醋酸与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4+ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的质量之比为9:1 | B. | 原子数之比为1:1 | ||
| C. | 分子数之比为1:1 | D. | 电子数之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管滴至终点对,俯视读数 | |
| B. | 锥形瓶用蒸馏水洗后,未干燥 | |
| C. | 酸式滴定管用蒸馏水洗后,未用标准液润洗 | |
| D. | 酸式滴定管滴定至终点后,发现尖嘴处有气泡(原来无气泡) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com