
| 实验一 | 实验二 | |
| 装置 | 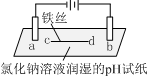 | 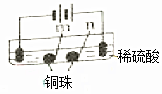 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-=H2↑+2OH- | |
| B. | b处:2Cl--2e-=Cl2↑ | |
| C. | 根据实验一的原理,实验二中m处能析出铜 | |
| D. | n处发生了反应:2H++2e-=H2↑ |
分析 实验一a、d处试纸变蓝,说明生成OH-,为电解池的阴极,b处变红,局部褪色,为电解池的阳极,生成氯气,c处无明显变化,铁丝左侧为阳极,右侧为阴极,
实验二两个石墨电极附近有气泡产生,左侧生成氢气,右侧生成氧气,两个铜珠的左侧为阳极,右侧为阴极,n处有气泡产生,为阴极,以此解答该题.
解答 解:A.d处试纸变蓝,为阴极,生成OH-,电极方程式为2H2O+2e-═H2↑+2OH-,故A正确;
B.b处变红,局部褪色,是因为Cl2+H2O=HCl+HClO,HCl的酸性使溶液变红,HClO的漂白性使局部褪色,故B错误;
C.实验一中ac形成电解池,db形成电解池,所以实验二中也相当于形成三个电解池,一个球两面为不同的两极,左边铜珠的左侧为阳极,发生的电极反应为Cu-2e-=Cu2+,右侧(即位置m处)为阴极,发生的电极反应为Cu2++2e-=Cu,同样右边铜珠的左侧为阳极,右侧(即位置n处)为阴极,因此m处能析出铜的说法正确,故C正确;
D.n处发生了反应:2H++2e-=H2↑,故D正确;
故选B.
点评 本题考查电解原理,侧重于学生的分析能力的考查,注意把握电极的判断以及电极反应,为解答该题的关键,题目易错点为D,注意铜珠的左右侧可看出阴、阳极,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中加入Cu粉:Cu+Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2═CaCO3↓+2H+ | |
| C. | 饱和FeCl溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的凹槽与上口部的小孔对准,然后进行分液 | |
| C. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 | |
| D. | 提取碘水中的碘单质时,应选择有机萃取剂如乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入少量NaHSO4:OH-+H+═H2O | |
| B. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | NaOH溶液中通入足量的CO2:OH-+CO2═HCO3- | |
| D. | Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g | B. | 15.6g | C. | 3.9g | D. | 78g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试纸在使用时必须先要湿润 | |
| B. | 任何金属或者它们的化合物在火焰上灼烧都有特殊的焰色反应 | |
| C. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| D. | 提纯混有少量硝酸钾的氯化钠,需经过溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应中其还原剂是Na2O2.
,反应中其还原剂是Na2O2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com