
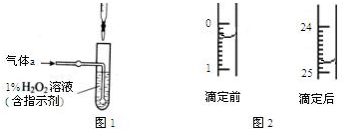
分析 ①H2O2氧化SO2生成硫酸;
②用酸式滴定管取液时快速放液可以赶走气泡;
③用氢氧化钠滴定硫酸溶液时可以用酚酞作指示剂,滴定终点时溶液由无色变为浅红色;
④根据图2可知,滴定前滴定管的刻度为0.3mL,滴定后滴定管的刻度为24.8mL,消耗NaOH溶液体积的平均值为 z mL,则氢氧化钠的物质的量为c mol/L×z×10-3L=cz10-3mol,所以硫酸的物质的量为$\frac{1}{2}$×cz10-3mol,根据硫元素守恒可计算得钢样中硫的质量分数;
⑤a.水洗后未用标准液润洗碱式滴定管,则标准液被稀释,消耗的氢氧化钠溶液的体积偏大;
b.加入 1mL 酸碱指示剂,指示剂用量偏多,则消耗一定量的氢氧化钠溶液,会使标准液体积偏大;
c.滴定终点时,尖嘴出现气泡,则会使标准液体积偏小;
d.滴定终点俯视滴定管的刻度,则标准液体积读数会偏小,据此答题;
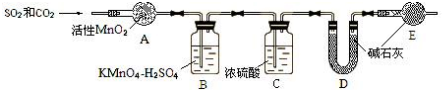
⑥根据装置图可知,二氧化硫和二氧化碳混合气体通过活性二氧化锰装置和高锰酸钾溶液二氧化硫被吸收,通过浓硫酸水分被吸收;
⑦经过除杂后的二氧化碳被碱石灰吸收,根据碱石灰的质量的变化可知生成二氧化碳的质量,根据碳元素守恒可知样品中碳的质量分数;空气中的水分和二氧化碳也能被碱石灰吸收,所以如果没有E装置,D的质量变化偏大,据此答题;
⑧SO2被氧化成硫酸后,溶液中的 c(H+)增大,使 CO2 的溶解平衡向逆向移动,导致 CO2 在水中几乎不溶,不会对测定SO2 产生影响,CO2 和 SO2 都能被碱石灰吸收,因此测定 CO2 时必须除去 SO2,据此答题;
解答 解:①H2O2氧化SO2生成硫酸,反应的化学方程式为SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
②用酸式滴定管取液时赶走气泡的操作是快速放液,
故答案为:快速放液;
③用氢氧化钠滴定硫酸溶液时可以用酚酞作指示剂,滴定终点时溶液的颜色变化为:恰好使溶液由无色变为浅红色,且半分钟内不褪色,
故答案为:酚酞;恰好使溶液由无色变为浅红色,且半分钟内不褪色;
④根据图2可知,滴定前滴定管的刻度为0.30mL,滴定后滴定管的刻度为24.80mL,所以NaOH 溶液的体积读数为24.50mL,消耗NaOH溶液体积的平均值为 z mL,则氢氧化钠的物质的量为c mol/L×z×10-3L=cz10-3mol,所以硫酸的物质的量为$\frac{1}{2}$×cz10-3mol,根据硫元素守恒可知钢样中硫的质量分数为$\frac{\frac{1}{2}×cz10{\;}^{-3}mol×32g/mol}{xg}$×100%=$\frac{8cz}{5x}$%,
故答案为:24.50mL;$\frac{8cz}{5x}$%;
⑤a.水洗后未用标准液润洗碱式滴定管,则标准液被稀释,消耗的氢氧化钠溶液的体积偏大,会造成测定结果偏高;
b.加入 1mL 酸碱指示剂,指示剂用量偏多,则消耗一定量的氢氧化钠溶液,会使标准液体积偏大,会造成测定结果偏高;
c.滴定终点时,尖嘴出现气泡,则会使标准液体积偏小,会造成测定结果偏低;
d.滴定终点俯视滴定管的刻度,则标准液体积读数会偏小,会造成测定结果偏低,
故答案为:ab;
⑥根据装置图可知,二氧化硫和二氧化碳混合气体通过活性二氧化锰装置和高锰酸钾溶液二氧化硫被吸收,通过浓硫酸水分被吸收,
故选:AB;
⑦经过除杂后的二氧化碳被碱石灰吸收,根据碱石灰的质量的变化可知生成二氧化碳的质量,根据碳元素守恒可知样品中碳的质量分数,所以要测量装置D吸收气体前后的质量,空气中的水分和二氧化碳也能被碱石灰吸收,所以如果没有E装置,D的质量变化偏大,所以会使测得的碳的含量偏大,
故答案为:装置D吸收气体前后的质量;偏大;
⑧SO2被氧化成硫酸后,溶液中的 c(H+)增大,使 CO2 的溶解平衡向逆向移动,导致 CO2 在水中几乎不溶,不会对测定SO2 产生影响,CO2 和 SO2 都能被碱石灰吸收,因此测定 CO2 时必须除去 SO2,所以合理,
故答案为:合理,SO2被氧化成硫酸后,溶液中的 c(H+)增大,使 CO2 的溶解平衡:;向逆向移动,导致 CO2 在水中几乎不溶,不会对测定SO2 产生影响,CO2 和 SO2 都能被碱石灰吸收,因此测定 CO2 时必须除去 SO2.
点评 本题考查了C、S含量的测定,涉及氧化还原反应的书写、根据元素守恒的有关计算等知识点,明确实验原理是解本题关键,结合物质的性质来分析解答,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝 | |
| D. | 生铁、普通钢和不锈钢中的含碳量依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛浓硝酸、硝酸银用棕色试剂瓶,并置于阴凉处 | |
| B. | 用带玻璃塞的磨口玻璃瓶盛氢氧化钠 | |
| C. | 金属钠通常保存在煤油里 | |
| D. | HF酸储存在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④⑤ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| B. | 化学反应速率为“0.8 mol•L-1•s-1”所表示的意思是时间为1 s时,某物质的浓度为0.8 mol•L-1 | |
| C. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com