
| 4.4g |
| 44g/mol |
| 2.7g |
| 18g/mol |
| 0.8g |
| 16g/mol |
| 4.4g |
| 44g/mol |
| 2.7g |
| 18g/mol |
| 0.8g |
| 16g/mol |


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | ||
| B、根据滴定曲线,可得Ka(HY)≈10-5 | ||
| C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
D、HY与HZ混合,达到平衡时:c(H+)═
|
查看答案和解析>>
科目:高中化学 来源: 题型:
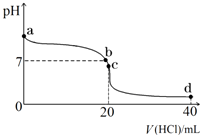 室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
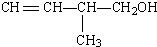
查看答案和解析>>
科目:高中化学 来源: 题型:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| TiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )
可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )| A、温度降低,化学平衡向正反应方向移动 |
| B、使用催化剂,D的物质的量分数增加 |
| C、化学方程式系数m+n=r+q |
| D、物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中所有碳原子不在同一条直线上 |
| B、比乙烷的密度大 |
| C、比丁烷更容易液化 |
| D、是石油分馏的一种产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com