
| A. | 碘化钾--加碘盐 | B. | 氧化铝--耐火材料 | ||
| C. | 铁碳合金--碳素钢 | D. | 硅酸盐--普通玻璃 |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 蛋白质跟浓盐酸作用时呈黄色 | |
| B. | 聚乙烯塑料制品可用于食品的包装,而聚氯乙烯不能用于食品包装 | |
| C. | 木糖醇(C5H12O5)是一种甜味剂,与葡萄糖互为同系物 | |
| D. | 将一小块钠加入乙醇中,钠浮于乙醇上,缓慢反应生成氢气,说明乙醇中羟基上的氢原子相对于水不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
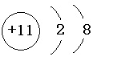 ,在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是Fe,所形成的氧化物中适宜做耐火材料的元素是Al;
,在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是Fe,所形成的氧化物中适宜做耐火材料的元素是Al;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
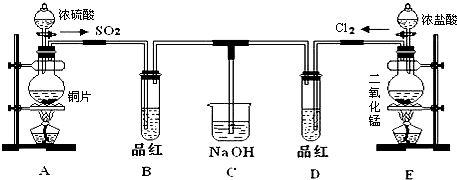
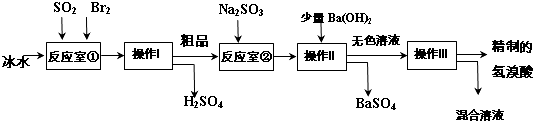
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能与水反应生成碱,但过氧化钠不是碱性氧化物 | |
| B. | 检验FeCl3溶液中的少量Fe2+,可以用KSCN溶液 | |
| C. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 | |
| D. | 普通玻璃是纯净物,其组成可用Na2O•CaO•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
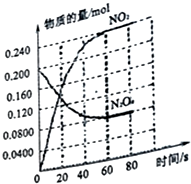 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试管 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com