
【题目】在2 L的密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________mol·L-1·min-1,达平衡时B物质的浓度为________,A的转化率为________。
(2)实验2中,隐含的反应条件可能是________。
(3)实验3中,A的起始的物质的量________(填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________(填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________(填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________。
【答案】 5.75×10-3 0.125molL-1 50% 缩小容器的体积或使用催化剂 > > 吸热 4 0.5 molL-1
【解析】(1)实验1中10至30分钟A的物质的量的改变量为0.80mol-0.57mol=0.23mol,所以用A表示的反应速率ν(A)= ![]() 5.75×10-3mol/(L·min);由表中数据可知达到平衡时A的物质的量改变了0.5mol,所以A的转化率为=
5.75×10-3mol/(L·min);由表中数据可知达到平衡时A的物质的量改变了0.5mol,所以A的转化率为=![]() =50%;由化学方程式可得B的物质的量改变0.25mol,所以平衡时B的浓度为c(B)=
=50%;由化学方程式可得B的物质的量改变0.25mol,所以平衡时B的浓度为c(B)=![]() =0.125mol/L。
=0.125mol/L。
(2)实验1、2相比,实验2在相同的时间段内,A消耗的多,即实验2的速率比实验1大,但平衡时A的物质的量不变,结合反应前后气体体积不变的特点,所以实验2中隐含的反应条件可能是缩小容器的体积即加压、或使用了催化剂;
(3)实验3和实验1相比,平衡时A的物质的量增大,说明A的起始物质的量大于1.0mol;因此A的起始浓度大于实验1的,反应速率也大于实验1的,即v3>v1;实验5是实验1升高温度的结果,平衡时A的物质的量减小了,即升高温度,平衡正向移动,说明该反应为吸热反应;根据实验4的数据可知,该温度下的平衡常数K=![]() =
= ![]() =4;
=4;
(4)若开始时在实验2的密闭容器中充入1molB,1molD,由于反应前后气体体积不变,所以这时建立的平衡与实验2是等效平衡,只是浓度是实验2的二倍,即达平衡时A物质的浓度为=![]() =0.50mol/L。
=0.50mol/L。


科目:高中化学 来源: 题型:
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)![]() CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
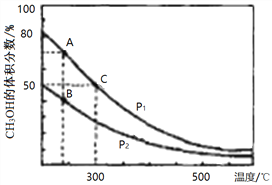
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率 | 平衡常数K | 平衡转化率α |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
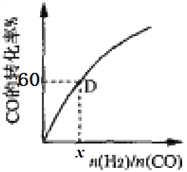
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+B![]() aC+2D,经5 min后,此时C为0.2 mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
aC+2D,经5 min后,此时C为0.2 mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A. 此时,反应混合物总的物质的量为1 mol B. B的转化率为50%
C. A的平均反应速率为0.1 mol·L-1·min-1 D. a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应A(g)+B(g)![]() 2C(g)+D(g) ΔH=Q kJ·mol-1 过程中的能量变化如图所示,回答下列问题。
2C(g)+D(g) ΔH=Q kJ·mol-1 过程中的能量变化如图所示,回答下列问题。

(1)Q________0(填“>”“<”或“=”)。
(2)熵变ΔS________0(填“>”“<”或“=”)。
(3)该反应________自发进行(填“能”或“不能”)。
(4)升高温度平衡常数K________(填“增大”“减小”或“不变”),平衡向________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:
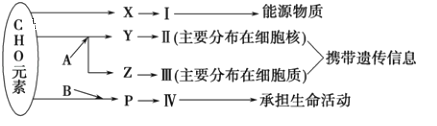
(1)图中X是_____,Ⅰ在小麦种子中主要是指_____。
(2)图中Z是_____,使用甲基绿、吡罗红混合染液染色,可使Ⅲ呈现_____色。
(3)图中P的结构通式为___________;写出由P形成Ⅳ的结构层次依次为________________________。
(4)鉴定Ⅳ时需使用双缩脲试剂,应先加_____,造成碱性环境,再加_____。(填试剂名称)
(5)分析如图中化合物的结构,回答问题。

该化合物中④表示_______。该化合物是由_____种氨基酸通过脱水缩合方式形成的,该化合物叫____________,若完全水解成为氨基酸则需要_______个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,试管中盛有的水含几滴酚酞,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象预测错误的是 ( )

A. 气球a被吹大 B. 试管内溶液先变红后褪色
C. U形管内红色退去 D. U形管水位d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首台静默移动发电站MFC30 正式问世,MFC30 是基于甲醇重整制氢燃料电池发电技术。已知甲醇制氢方式主要有以下三种:
方法Ⅰ甲醇水蒸气重整制氢:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1= +49.4kJ/mol
CO2(g)+3H2(g) ΔH1= +49.4kJ/mol
方法Ⅱ甲醇氧化重整制氢: CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+ 2H2(g) ΔH2=-192.4 kJ/mol
CO2(g)+ 2H2(g) ΔH2=-192.4 kJ/mol
方法Ⅲ甲醇分解制氢:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知CO 的燃烧热△H=-283.0kJ/mol,请结合方法Ⅱ的热化学方程式计算△H3=__________,该反应在_________条件(“高温”,“低温”或“任意温度”下自发进行。
(2)实验室模拟方法Ⅰ制氢,当合成气组成n(CH3OH)∶n(H2O)=1∶1时,体系中甲醇的平衡转化率与温度和压强的关系如图甲所示。

①温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________________;
②图中的压强由小到大的顺序是___________________,理由是_________________________________。
(3)方法Ⅲ制H2的能量变化曲线如图乙所示。图中由曲线a变化到曲线b应采取的措施是_____________________。恒温恒容时,下列选项能说明该反应达到平衡状态的是___________。
a.v正(CO)=2v逆(H2) b.体系的平均摩尔质量不再改变
c.H2的浓度保持不变 d. △H不再改变
(4)甲醇会对水质造成一定的污染,有一种电化学方法可以消除这种污染,原理是在通电的条件下将酸性溶液中的Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。请写出Co3+去除甲醇的离子方程式______________________________。
(5)MFC30 燃料电池是以氢气为燃料、熔融Li2CO3与K2CO3混合物为电解质的高温型燃料电池,其负极的电极反应式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com