
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
分析 (1)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(2)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(3)根据方程式中转化关系以及原子守恒计算.
解答 解:(1)c组实验中盐酸完全反应,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol
则c(HCl)=$\frac{2×0.03mol}{0.03L}$=2mol/L.
答:盐酸的浓度为2mol/L.
(2)设0.510合金中Mg?Al的物质的量分别为x?y,
由于a组实验中金属完全反应,生成氢气n(H2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,
由合金质量知:x×24g/mol+y×27g/mol=0.510g ①
由反应得失电子数相等得:2x+3y=0.025mol×2 ②
解①②得:x=y=0.01 mol
则合金中镁的质量分数=$\frac{0.01mol×24g/mol}{0.510g}×100%=47.06%$
答:合金中镁的质量分数为47.06%.
(3)c组实验合金中n(Al)=n(Mg)=0.01mol×$\frac{0.918g}{0.510g}$=0.018mol
与盐酸恰好反应后,溶液中只有AlCl3和MgCl2
溶解0.918g合金共需要n(HCl)=0.018 mol×3﹢0.018 mol×2=0.09mol
V(HCl)=$\frac{0.09mol}{2mol/L}=0.045L=45mL$ 答:在c组实验后,还需向容器中加入15mL同浓度的盐酸才能使剩余合金恰好完全溶解.
点评 本题考查了合金的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合原子守恒进行计算,题目难度较大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
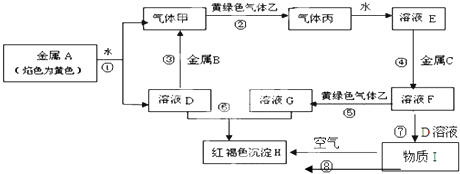
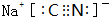 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
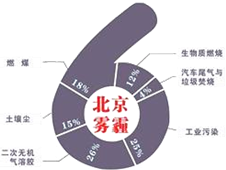 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉 | B. | 蔗糖 | C. | 果糖 | D. | 麦芽糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
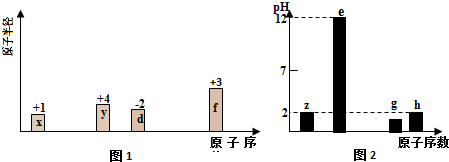
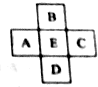 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com