
���� ��1��̼��Ʋ�����ˮ��
��2������ˮ�ֲ㣻
��3���Ҵ��ķе�ͣ�
��4���ⲻ������ˮ���������л��ܼ���
��5������������
��� �⣺��1��̼��Ʋ�����ˮ�������ù��˷����룬�ʴ�Ϊ��C��
��2������ˮ�ֲ㣬��ѡ���Һ�����룬�ʴ�Ϊ��B��
��3���Ҵ��ķе�ͣ���ѡ�������룬�ʴ�Ϊ��F��
��4���ⲻ������ˮ���������л��ܼ�����ѡ����ȡ����Һ�����룬�ʴ�Ϊ��B��BA����
��5��������������ѡ�����������룬�ʴ�Ϊ��E��
���� ���⿼����������ᴿ��Ϊ��Ƶ���㣬�������ʵ����ʡ����ʲ��켰�����ķ�ӦΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע����뷽����ԭ������Ŀ�Ѷ��еȣ�


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ӧˮ�������ԣ�X��R | |
| B�� | ���Ӱ뾶��Z��W | |
| C�� | pH=10��Na2R��Һ����ˮ�������c��H+��=10-10mol•L-1 | |
| D�� | ��̬�⻯���ȶ��ԣ�W��R |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
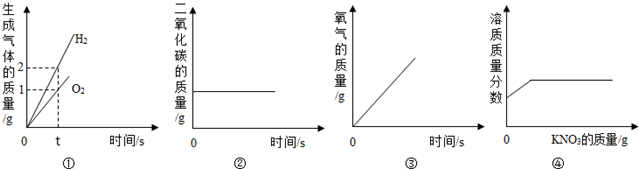
| A�� | ��ˮ�ĵ�� | |
| B�� | ��ľ̿���ܱյ�������ȼ�� | |
| C�� | �ۼ���һ�����ĸ������������ | |
| D�� | ��20��ʱ����һ�����ӽ����͵��������Һ�м�������ع��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
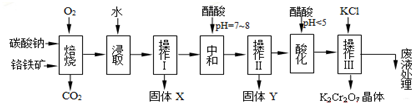
| ���� | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| �ܽ�� ��g/100gˮ�� | 0�� | 28 | 35.7 | 4.7 | 163 |
| 40�� | 40.1 | 36.4 | 26.3 | 215 | |
| 80�� | 51.3 | 38 | 73 | 376 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢܢ� | C�� | �ڢۢ� | D�� | �ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
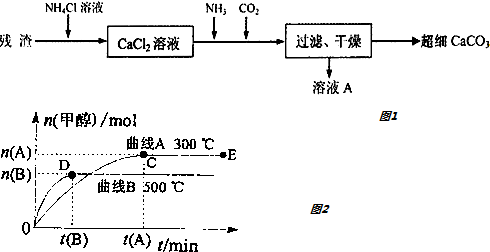
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | H2��g�� | CO2��g�� | CH2=CH2��g�� | H2O��g�� |
| ����/kJ•mol-1 | 0 | -394 | 52 | -242 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ�����mL�� | HCl��Һ�����mL�� | |
| �ζ�ǰ���� | �ζ������ | ||
| ��һ�� | 10.00 | 0.50 | 20.51 |
| �ڶ��� | 10.00 | 4.00 | 24.00 |
| ������ | 10.00 | 5.11 | 25.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0 mol•L-1 KNO3��Һ��H+��Fe2+��SCN-��SO42- | |
| B�� | ˮ�������c��H+��=10-10 mol•L-1����Һ��K+��Ba2+��NO3-��Cl- | |
| C�� | pH=0����Һ��Al3+��Ag��NH3��2+��Cl-��SO42- | |
| D�� | c��ClO-��=1.0 mol•L-1����Һ��Na+��SO32-��S2-��SO42- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com