
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是____,所加40%NaOH不宜过量太多的原因是____。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,该反应的离子方程式为____。
(3)使用下列用品来测定溶液的pH,合理的是____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
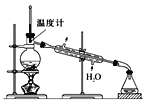
①该装置中存在的错误是____。
②在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:____。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
【答案】 将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-) 避免还原时消耗过多盐酸 10H++2CrO42-+CH3OH=2Cr3++7H2O+ CO2↑ AB 用明火加热、体系封闭 没有必要,CH3OH参与反应的体系中有水 完全溶解于过量的盐酸中 蒸发浓缩 用乙醚洗涤固体2~3次
【解析】用40%NaOH将红矾钠(Na2Cr2O7)转化为铬酸钠(Na2CrO4),再用CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,加20%NaOH使Cr3+沉淀为Cr(OH)3,过滤,将过滤后所得固体用盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,低温干燥,即得CrCl36H2O晶体。
(1)碱溶使Cr2O72-+H2O2CrO42-+2H+的平衡正向移动,将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);所加40%NaOH不宜过量太多,因后需加更多的盐酸还原,故答案为:将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);避免还原时消耗过多盐酸;
(2)CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,反应为10H++2CrO42-+CH3OH= 2Cr3++7H2O+CO2↑,故答案为:10H++2CrO42-+CH3OH=2Cr3++7H2O+CO2↑;
(3)测定溶液的pH可用pH计、pH试纸,故答案为:AB;
(4)①根据题意,甲醇易燃,不能用明火加热,装置最后的锥形瓶没有出气口,是一个封闭体系,故答案为:用明火加热、体系封闭;
②CH3OH参与反应的体系是水溶液,因此没有必要加入CaO,故答案为:没有必要,CH3OH参与反应的体系中有水;
(5)过滤后所得Cr(OH)3用过量的盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,即得CrCl36H2O晶体,故答案为:完全溶解于过量的盐酸中;蒸发浓缩;用乙醚洗涤固体2~3次。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a = 2,b = 1 B. a=39,b =2 C. a=2,b = 2 D. a=3,b = 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述,不正确的是
A. 合金的熔点一般比它的成分金属熔点低
B. 合金的硬度一般比它的成分金属的大
C. 合金的性质一般是各成分金属性质的总和
D. 青铜是我国最早使用的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。

(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?____。
(2)试管I内的试剂X是__时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,则所得的结论是____。
(3)试管I内试剂为CO2饱和水溶液时,其他操作同(2),通过____的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
__Na2O2+____C18O2+____H218O→____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
B. 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA
C. 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
D. 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素; Z原子的最外层电子数是其最内层电子数的![]() ;W的最高正价和最低负价的代数和为0。下列说法正确的是
;W的最高正价和最低负价的代数和为0。下列说法正确的是
A. 原子半径:X<Y<Z<W
B. Z的氢化物中只含离子键
C. 最高价氯化物对应水化物的酸性:Y>W
D. X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关离子检验的说法不正确的是
A. 检验Cl—时发生的离子反应为:Ag++Cl—=AgCl↓
B. 检验SO42—时发生的离子反应为:Ba2++ SO42—==BaSO4↓
C. 待测液中滴入KSCN溶液,若溶液变血红色,则待测液中存在Fe3+
D. 待测液中滴入盐酸,若产生CO2,则待测液中存在CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 所有共价键都有方向性
B. H3O+离子的存在,说明共价键不应有饱和性
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com