
 ��2 �֣�
��2 �֣� 2Cu + O2�� + 2H2SO4��2�֣�
2Cu + O2�� + 2H2SO4��2�֣�  mol��L
mol��L 2Cu + O2�� + 2H2SO4 ��
2Cu + O2�� + 2H2SO4 ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
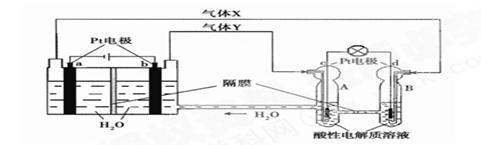
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
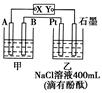
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ó�����������Һʱ����������ʴ |
| B����ⷨ������ͭ���ô�ͭ������ |
| C�����ˮ������ʱ����ͭ������ |
| D���ڶƼ��ϵ��п����п������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
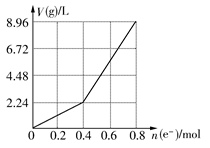
| A�����ǰCuSO4��Һ�����ʵ���Ũ��Ϊ2 mol/L |
| B������������Һ��c(H��)��2 mol/L |
| C����n(e��)��0.6 molʱ��V(H2)��V(O2)��2��3 |
| D����������Һ�м���16 g CuO������Һ�ɻָ�Ϊ���ǰ��Ũ�� |
�鿴�𰸺ͽ���>>
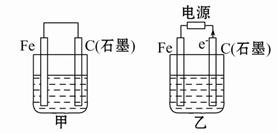
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������������ɵ��������� |
| B�����������ö��Ե缫 |
| C�����������ö��Ե缫 |
| D��ʯī�����Ƚ����������ڵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
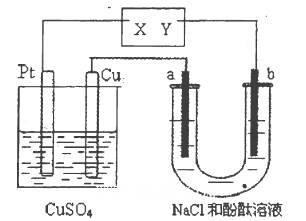
| A��X��������Y�Ǹ��� | B��X�Ǹ�����Y������ |
| C��CuSO4��Һ��Ũ����С | D��CuSO4��Һ��pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com