
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:不详 题型:单选题
| A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解 |
| B.与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| C.常温下,铝在浓硝酸中钝化而铜不发生钝化 |
| D.常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | R | | |
| T | Q | | W | K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
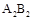
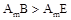
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、Y的单质均可以导电 |
| B.原子半径:Z>W |
| C.X、Z的氧化物均为酸性氧化物 |
| D.Y、W的最高价氧化物的水化物均易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com