
【题目】常温下,用0.1000 mol·L-1的NaOH溶液与25.00 mL 0.1000 mol·L-1HA(-元酸)溶液进行滴定实验,得到滴定曲线(如图所示),下列说法不正确的是

A.HA为-元弱酸
B.常温下,HA的电离平衡常数Ka=10-5
C.M点时溶液的pH=7,此时加入的V(NaOH)<25.00 mL
D.可选用甲基橙作指示剂,到达滴定终点时溶液由红色变为黄色
【答案】D
【解析】
A. HA溶液的浓度为0.1000 mol·L-1,若为强酸其pH值应为1,从图中起点可看未滴加氢氧化钠时其pH值为3,故为弱酸,故A说法正确;
B.电离平衡常数 ,跟据图像起点可知,0.1000 mol·L-1HA溶液中c(H+)=1×10-3mol/L,根据电离方程式
,跟据图像起点可知,0.1000 mol·L-1HA溶液中c(H+)=1×10-3mol/L,根据电离方程式![]() ,可知c(A-)=1×10-3mol/L,所以
,可知c(A-)=1×10-3mol/L,所以![]() ,故B项正确;
,故B项正确;
C.当加入的V(NaOH)=25.00 mL,恰好完全反应,溶液中溶质为NaA,由于A-水解会使溶液显碱性,故溶液呈中性时加入的V(NaOH)<25.00 mL,故C项正确;
D.滴定终点溶液中溶质为NaA,由于A-水解会使溶液显碱性,应用酚酞做指示剂,故D项错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】下列四幅图示所表示的信息与对应的叙述相符的是( )
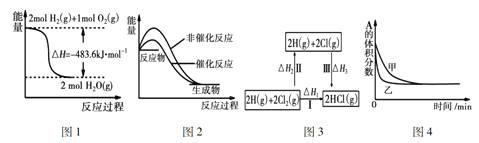
A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol—1
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D. 图4表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
![]() 写出符合下列条件的A的同分异构体的结构简式: ______ 。
写出符合下列条件的A的同分异构体的结构简式: ______ 。
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
![]() 化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______
化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______ ![]() 填字母
填字母![]() 。
。
A.能与氯化铁溶液显色![]() 分子中含有羧基、羟基等官能团
分子中含有羧基、羟基等官能团
C.能与溴水反应![]() 能与碳酸钠溶液反应产生二氧化碳
能与碳酸钠溶液反应产生二氧化碳
![]() 化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
![]() 化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
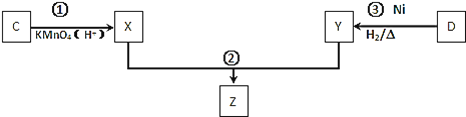
反应![]() 中D与
中D与![]() 按物质的量1:1反应生成Y,则反应
按物质的量1:1反应生成Y,则反应![]() 的化学方程式为 ______ 。
的化学方程式为 ______ 。
![]() 化合物D与银氨溶液反应的化学方程式
化合物D与银氨溶液反应的化学方程式![]() 有机物用结构简式表示
有机物用结构简式表示![]() : ______ 。
: ______ 。
![]() 化合物F是合成克矽平的原料之一,
化合物F是合成克矽平的原料之一,![]() 克矽平是一种治疗矽肺病的药物
克矽平是一种治疗矽肺病的药物![]() ,其合成路线如下
,其合成路线如下![]() 反应均在一定条件下进行
反应均在一定条件下进行![]() :
:

![]() 反应
反应![]() 是原子利用率
是原子利用率![]() 的反应,则该反应的化学方程式为 ______ ;
的反应,则该反应的化学方程式为 ______ ;
![]() 上述转化关系中没有涉及的反应类型是 ______
上述转化关系中没有涉及的反应类型是 ______ ![]() 填代号
填代号![]() 。
。
![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 还原反应
还原反应![]() 氧化反应
氧化反应![]() 加聚反应
加聚反应![]() 取代反应。
取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备Cl2通常采用如图所示装置:

(1)A装置中发生反应的化学方程式是________;每生成0.5 mol Cl2,被氧化的物质的物质的量是_____mol。
(2)仪器a的名称是_________;
(3)B装置中所盛的试剂是________________;
(4)实验时,通常采用密度为1.19 g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为________;
(5)将如图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C. 玻璃管中,钠燃烧时会产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
(6)E装置中发生反应的化学方程式是________________;为验证E装置反应后的溶液中存在Cl-,正确的操作是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是

A.铜片为负极,发生还原反应
B.电子由负极经盐桥移向正极
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式____;
(2)C装置的作用是____。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中,通入氢气的电极为________(填“正极”或“负极”),该极电极反应式为________;若将KOH溶液换成硫酸溶液,则正极电极反应式为__________________________。
(2)关于乙装置,下列说法正确的是________(填序号);
①溶液中Na+向C极移动
②从C极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下Fe极产生2.24L气体,则溶液中转移0.2mol电子
该装置中发生的总反应的离子方程式为__________________________。
(3)乙装置中,X为阳离子交换膜,反应一段时间后交换膜左侧溶液中pH____(填“增大”、“减小”或“不变”);若用饱和MgCl2溶液代替饱和氯化钠溶液,则该装置中发生的总反应______(填“改变”或“不变”)。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”),精铜电极上的电极反应式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:
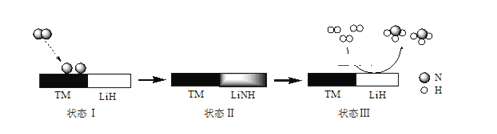
下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com