
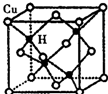
 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示). 分析 利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式$\frac{m}{V}$计算.
解答 解:该晶胞中含有4个H原子,铜原子个数=8×$\frac{1}{8}$$\frac{1}{2}$=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则d=$\frac{\frac{4×(64+1)}{{N}_{A}}}{{a}^{3}}$,所以a=$\root{3}{\frac{260}{d{N}_{A}}}$,
故答案为:$\root{3}{\frac{260}{d{N}_{A}}}$.
点评 本题主要考查了晶胞边长的计算,内容较少,比较简单,注重对基本方法的考查.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | SO3+H2O═H2SO4 | D. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
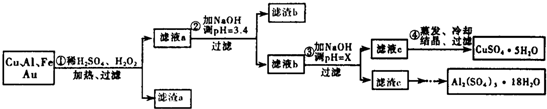
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
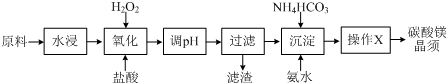
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.1 |
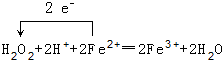 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O | |
| B. | MnO2与浓盐酸混合加热:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 等浓度等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 用NaOH溶液吸收少量H2S气体:OH-+H2S=HS-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com