
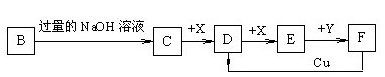
 N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。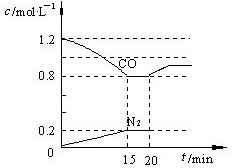
| | 2NO(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0 N2(g) + 2CO2(g);△H<0 | |||
| 始态mol | 1.4 | 1.2 | 0 | 0 |
| 反应mol | 0.4 | 0.4 | 0.2 | 0.4 |
| 终态mol | 1.0 | 0.8 | 0.2 | 0.4 |
| 再次通入 | 0 | 0.8 | 0.8 | 0 |
| 通入后 | 1.0 | 1.6 | 1.0 | 0.4 |


科目:高中化学 来源:不详 题型:单选题
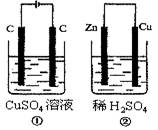
| A.右边电极上生成物质的物质的量:①=② |
| B.相同状态下电极上产生气体的体积:①=② |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阴极Cu2++2e-=Cu:②中负极:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
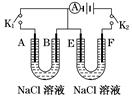

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
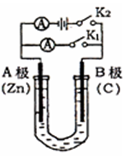
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极和阴极上都产生了气泡 |
| B.阳极处产生了气泡,此气泡使湿润的碘化钾淀粉试纸变蓝 |
| C.溶液出现了灰绿色浑浊,后逐渐变成了红褐色 |
| D.阴极处未产生气泡,滴入酚酞试剂后变红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
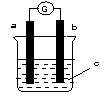
| A.a是锌,b 是铜,c 是H2SO4溶液 |
| B.a是铁,b 是银,c 是 AgNO3溶液 |
| C.a是银,b 是铁,c是AgNO3溶液 |
| D.a是铁,b是碳,c 是CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com