
| A. | 转移电子的物质的量为1.25 mol | |
| B. | 生成42.0 L N2(标准状况) | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被还原的N原子的物质的量为3.75 mol |
分析 该反应中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,根据原子守恒知,氧化产物与还原产物的物质的量之比为30:2=15:1,若氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,以此解答该题.
解答 解:该反应中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,根据原子守恒知,氧化产物与还原产物的物质的量之比为30:2=15:1,若氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol
A.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故A正确;
B.生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故B错误;
C.由反应可知,被还原的硝酸钾的物质的量为2mol×$\frac{2}{16}$=0.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为$\frac{1.25×30}{10}$mol=3.75mol,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重考查分析计算能力,明确元素化合价是解本题关键,注意叠氮化钠中N元素化合价,注意该反应中氧化产物和还原产物是同一种物质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 食品工业用Na2CO3作焙制糕点的膨松剂 | |
| C. | FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 | |
| D. | 明矾能生成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
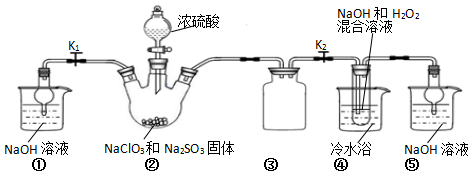 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
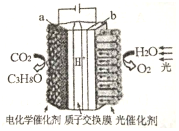 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b 极区向a 极区迁移 | |
| C. | 每生成1 mol O2,外电路有2 mol 电子转移 | |
| D. | a 电极的反应为:3CO2+18H+-18e--=C3H8O+5H2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥气体 | |
| C. | 次氯酸钙具有强氧化性,可用于消毒杀菌 | |
| D. | 氯化铁易水解,可用于腐蚀铜制线路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
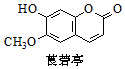
| A. | 分子中只含有一个手性碳原子 | |
| B. | 分子中所有碳原子可能处于同一平面 | |
| C. | 该物质能发生加成、取代和消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 4mol/LNaAlO2溶液与7mol/L盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+A13+ | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+=37Cl-+3Cl2↑+3H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++NH3↑+Ag+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水 | B. | 钠和水的反应2Na+2H2O═2NaOH+H2↑ | ||
| C. | 氟气和水反应2F2+2H2O═4HF+O2 | D. | 氯气和水反应Cl2+H2O═HCl+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com