
下列所得溶液的物质的量浓度等于0.1 mol·L-1的是
A.将0.1 mol氨充分溶解在1 L水中
B.将10 g质量分数为98%的硫酸与990 g水混合
C.将8 g三氧化硫溶于水并配成1 L溶液
D.将0.1 mol氧化钠溶于水并配成1 L溶液
C
【解析】
试题分析:A.将0.1mol氨气充分溶解在1L水中,所得溶液的体积不是1L,溶液的浓度不是0.1mol/L,故A错误;B.将10g质量分数为98%的硫酸与990g水混合,所得溶液中含有硫酸9.8g,物质的量为0.1mol,溶液质量为1000g,但是硫酸溶液的密度大于1g/mL,溶液的体积小于1L,所以溶液的物质的量浓度大于0.1mol/L,故B错误;C.8g三氧化硫的物质的量为0.1mol,0.1mol三氧化硫与水反应生成0.1mol硫酸,所得溶液浓度为0.1mol/L,故C正确;D.0.1mol氧化钠与水反应生成了0.2mol氢氧化钠,配成1L溶液后的浓度为0.2mol/L,故D错误;故选C。
考点:考查物质的量浓度计算、一定浓度的溶液配制


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(7分)现有部分元素的原子结构特点如下表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:_____ _______。
(2)元素X与元素Z相比,非金属性较强的是__ ____(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:___________ _________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为_______ _。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:______ _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质中均能造成大气污染的是
A.H2S、SO2、粉尘、煤烟、氮的氧化物、碳氢化合物
B.N2、NO2、粉尘、煤烟
C.CO2、O2、氮的氧化物、碳氢化合物
D.Cl2、N2、煤烟、氮的氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列实验方案不可行或结论不正确的是
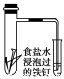
A.用湿润的pH试纸测定饱和Na2CO3溶液的pH
B.通过观察图中导管水柱的变化,验证铁钉生锈的主要原因是吸氧腐蚀
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积,比较两种酸的电离程度:醋酸<盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
在含有I-且能使甲基橙试液变红的溶液中能大量共存的离子组为
A.Fe3+、Na+、Br- B.NH4+、Na+、AlO2—
C.Ba2+、Al3+、Cl- D.K+、MnO4—、NO3—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:填空题
(13分)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32 -),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2 下列说法正确的是:
A.常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B.常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17mol2·L-2
C.常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D.向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:填空题
(11分)A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)

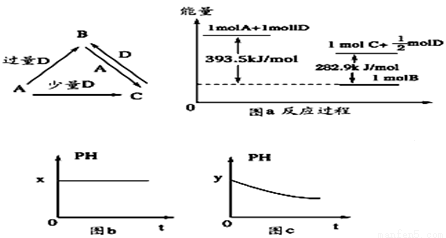
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为____________。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则①C的化学式为________________。
②反应B+A→C的离子方程式为____________________________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中 ________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com