
| 模拟海水中的 离子浓度/mol?L-1 | Na+ | Mg2+ | Ca2+ | Br- | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.008 | 0.552 | 0.001 |
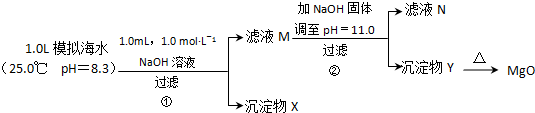
| 0.01mol |
| 1L |
| 4.2g |
| 40g/mol |
| 0.105mol-0.050mol×2 |
| 1L |


科目:高中化学 来源: 题型:
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
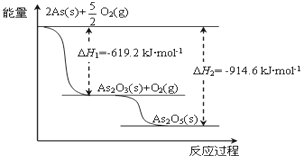 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
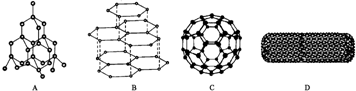
 可推算在石墨晶体中,每个正六边形平均所占有的C 原子数与C-C键数之比为
可推算在石墨晶体中,每个正六边形平均所占有的C 原子数与C-C键数之比为
查看答案和解析>>
科目:高中化学 来源: 题型:
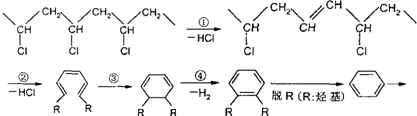
 与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:
与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将在空气中放置已久的这两种元素的单质分别和水反应 |
| B、将这两种元素的单质分别和同浓度的稀盐酸反应 |
| C、将这两种元素的单质分别与滴有酚酞溶液的水反应 |
| D、比较这两种元素的气态氢化物的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com