
| A. | ${\;}_y^m$X | B. | ${\;}_y^{y+m}$X | C. | ${\;}_{y+n}^{m+y-n}$X | D. | ${\;}_{y+n}^{m+y+n}$X |
科目:高中化学 来源: 题型:解答题
 已知:①CO2(g)+C(s)═2CO(g)△H1
已知:①CO2(g)+C(s)═2CO(g)△H1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol
已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol| A. | a,b,c,d四点中c正与v逆均相等 | |
| B. | 反应进行到10min时,体系吸收的热量为9.68kJ | |
| C. | 前10min内,用v(NO2)表示的该反应速率为0.02mol/L•min | |
| D. | 25min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
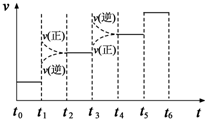 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | 等物质的量的硫酸氢钠与氢氧化钡溶液:SO42-+H++Ba2++OH-═H2O+BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 金属钠与H2O 反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com