
| ��� | ʵ�� | ���� |
| A | �ⶨ�������Ƶ�pH | �ø���Ľྻ������պȡ��Һ������pH��ֽ�ϣ���ɫ�������ɫ���Ա� |
| B | ����һ��Ũ�ȵ��Ȼ�����Һ1000mL | ȷ��ȡ�Ȼ��ع��壬���뵽1000mL������ƿ�У���ˮ�ܽ⣬��ҡ�ȣ����� |
| C | �ų���ʽ�ζ��ܼ��첿�ֵ����� | ����������ʹ��������б���ϣ�����ָ��ס���ܣ����ἷѹ�����飬ʹ��Һ�Ӽ���������� |
| D | ȡ����Һ©����������ϲ�Һ�� | ���²�Һ��ӷ�Һ©���¶˹ܿڷų��رջ�������һ�������������ӷ�Һ©���¶˹ܿڼ����ų��²�Һ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A������������Һ����Ư���ԣ�
B������ƿֻ������һ�����ʵ���Ũ����Һ�������ܽ��ϡ��ҩƷ��
C�������ܶȽ�С������������ʹ��������б���ϣ���ס���ܣ����ἷѹ�����飬ʹ��Һ�Ӽ����������ɽ����ݸϳ���
D����Һʱ���ϲ�Һ����Ͽڵ������²�Һ����¿ڵ�����
��� �⣺A������������Һ����Ư���ԣ����Բ�����pH��ֽ�ⶨ����������Һ��pH��Ӧ����pH�ƣ���A����
B������ƿֻ������һ�����ʵ���Ũ����Һ�������ܽ��ϡ��ҩƷ����B����
C�������ܶȽ�С������������ʹ��������б���ϣ���ס���ܣ����ἷѹ�����飬ʹ��Һ�Ӽ����������ɽ����ݸϳ����Ӷ�ʵ��ʵ���ų�����Ŀ�ģ���C��ȷ��
D����Һʱ���ϲ�Һ����Ͽڵ������²�Һ����¿ڵ����������ײ������ʣ���D����
��ѡC��
���� ���⿼�黯ѧʵ�鷽�����ۣ�Ϊ��Ƶ���㣬�漰ʵ�������������ȷʵ��ԭ����ʵ������淶���ǽⱾ��ؼ����״�ѡ����A��ע��pH��ֽ���ܲⶨ�����ᡢ����������Һ��pH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
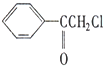 �й��ǡ�������Э���顷�ĵ�Լ��������ʹ�û�ѧ�����������κ���ʽ�Ļ�ѧ������ɢ��������ͪ��һ�־��кɻ���ζ����ǿ�������õ�ɱ���Ի�ѧ���������Ľṹ��ʽΪ��
�й��ǡ�������Э���顷�ĵ�Լ��������ʹ�û�ѧ�����������κ���ʽ�Ļ�ѧ������ɢ��������ͪ��һ�־��кɻ���ζ����ǿ�������õ�ɱ���Ի�ѧ���������Ľṹ��ʽΪ�� ��
�� ��
�� ��
�� ������
������ ��
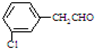
�� ����дһ�������ṹ����
����дһ�������ṹ���� ����ˮ��ַ�Ӧ��������4mol�����壻
����ˮ��ַ�Ӧ��������4mol�����壻 ��������ȫ�ӳɺ�IJ���Ľṹ��ʽ
��������ȫ�ӳɺ�IJ���Ľṹ��ʽ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������������ӵĻ����Һ�м�������NaOH��Һ�������ú��Һ���ɳ�ȥ������������ | |
| B�� | ȡ������ҺX�������м�������������ˮ���ټӼ���KSCN��Һ����Һ��죬˵��X��Һ��һ������Fe2+ | |
| C�� | ��FeCl3��Һ�еμӹ�����ˮ������ȡFe��OH��3���� | |
| D�� | ��֪I-3?I2+I-����ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C14H18O5 | B�� | C14H16O4 | C�� | C16H22O5 | D�� | C16H20O5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ���ڷ�Ӧ���б��������ڢ��б���ԭ | |
| B�� | ��Ӧ���е���1 mol Cl2����ԭʱ����2 mol Br-������ | |
| C�� | ������ǿ��˳��Ϊ��Cl2��I2��Br2��Fe3+ | |
| D�� | ��ԭ��ǿ��˳��Ϊ��I-��Fe2+��Br-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | nCH2�TCH2$\stackrel{����}{��}$ | B�� | C2H5Cl+NaOH��CH2=CH2+NaCl+H2O | ||
| C�� | CH3CH2CHO+HCN��CH3CH2CH��CN��OH | D�� | CH3COOH+C2H5OH��CH3COO C2H5+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Թܼ���̼�����ƹ���ʱʹ�Թܿ���ֱ���� | |
| B�� | Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ | |
| C�� | ��ʯ�ͷ����ʵ���У���Ҫ��������ƿ�м������Ƭ | |
| D�� | �¶ȼ�ˤ������ˮ��ɢ�䵽�����ϣ�Ӧ������ˮ��ϴˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ��Ħ��������18 g | |
| B�� | 0.012 kg 12C��Լ����6.02��1023��̼ԭ�� | |
| C�� | 1 molˮ��Լ����6.02��1023����ԭ�� | |
| D�� | 1 mol�κ����ʶ�����6.02��1023������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
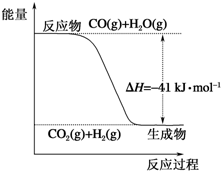 ��1������ͼʾд���Ȼ�ѧ����ʽ��CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ•mol-1��
��1������ͼʾд���Ȼ�ѧ����ʽ��CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ•mol-1���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com