
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验A | 条件 | 现象 |
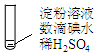 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取8.6mL浓硫酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 用500mL的容量瓶来配制需要的450mL溶液 | |
| D. | 用胶头滴管取5mL的某溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com