
(8分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:
(1)A的化学式_____________,C的电子式:_________________;
(2)A、B、C三者发生反应的离子方程式:__________________________
(3)已知D和G反应时还有使带火星的木条复燃的气体产生,则D和G反应的化学方程式为:_ _。
科目:高中化学 来源:2013届江西省南昌二中高三第一次考试化学试卷(带解析) 题型:填空题
(8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题:
①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省宜春市高三上学期第五次月考理综化学试卷(解析版) 题型:填空题
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省郑州市高三第三次测验预测理综化学试卷(解析版) 题型:填空题
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第三次诊断性测试化学试卷 题型:填空题
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: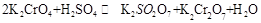
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)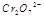 在水溶液中为红色,
在水溶液中为红色,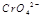 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用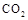 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用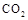 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
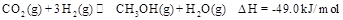
某科学实验将6mol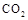 和8molH
和8molH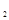 充入一容积为2L的密闭容器中,测得H
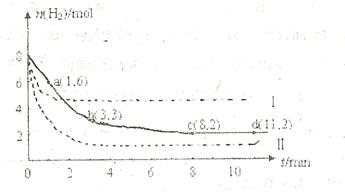
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com