
| A、K+一定存在 |
| B、100 mL溶液中含0.02 mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
| 0.896L |
| 22.4L/mol |
| 0.896L |
| 22.4L/mol |
| 4.66g |
| 233g/mol |
| 1.64g |
| 197g/mol |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
A、实验室用装置A制取氨气.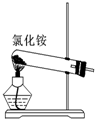 |
B、用B装置吸收氨气,并防止倒吸.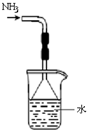 |
C、用C装置稀释浓硫酸C. |
D、用D装置除去CO2中的HCl.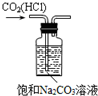 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 反应物(室温) | 催化剂 |
| a | 10mL5%H2O2溶液+1mLH2O | 0.1gMnO2粉末 |
| b | 10mL5%H2O2溶液+1mL稀HCl | 0.1gMnO2粉末 |
| c | 10mL5%H2O2溶液+1mL稀NaOH溶液 | 0.1gMnO2粉末 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的分子式为C2H4O3 |
| B、A的结构简式为HO-CH2-COOH |
| C、1 mol A与足量的单质Na反应时放出H2的物质的量为1.0mol |
| D、A分子中的官能团有两种,这两种官能团之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| B、室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 |
| C、向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D、向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4(s) |
| B、NaOH |
| C、(NH4)2SO4(s)? |
| D、K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol/L的溶液中:Na+、AlO2-、Cl-、NO3- |
| B、在既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、NH4+、K+、NO3- |
| C、在水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、SO42-、ClO-、Cl- |
| D、在pH=13的溶液中:SO32-、S2-、Na+、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com