
下列有关说法正确的是
A.常温下,4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0
B.检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液
C.锌与稀硫酸反应时加少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp (BaCO3)<Ksp (BaSO4)
科目:高中化学 来源: 题型:
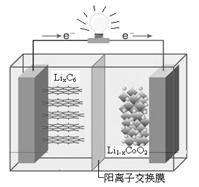
某种可充电聚合物锂离子电池放电时的反应为Li1-xCoO2 +LixC6 === 6C + LiCoO2,其工作原理示意图如右。下列说法不正确的是
A.放电时LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C. 充电时将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为:Li1-xCoO2 + xLi+ + xe— = LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是( )
A.溶液的pH相同
B.分别加入足量锌片,盐酸生成的H2体积大
C.分别稀释100倍后,醋酸浓度与盐酸浓度相等
D.由水电离出的氢离子浓度均为1×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是: 。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为: 。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是: ,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
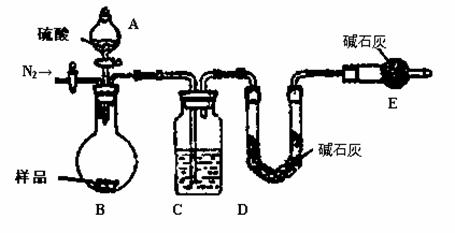
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是 。
(2)反应前后都要通入N2,反应后通入N2的目的是:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A.Na2CO3溶液的水解:CO32—+H3O+ HCO3—+H2O
HCO3—+H2O
B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
D.向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从煤干馏粗产品煤焦油中可以分离出萘,以萘为主要原料合成除草剂敌草胺的流程图如下:
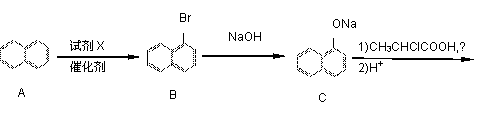

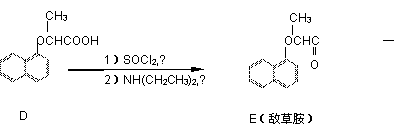

(1)A生成B时,有另一种一溴代物副产物,它的结构简式为 。
(2)试剂X是 。
(3)向C的水溶液中通入少量的二氧化碳会析出有机物W和无机物,写出化学反应方程式:
;W是一种常用的抗氧剂,理由是 。
(4)同时符合下列条件的D的同分异构体有多种:①能遇氯化铁溶液变紫色;②能发生水解反应;③它是A的衍生物;④在稀硫酸中水解,得到的含环产物在核磁共振谱图上有4个信号峰,另一种产物在核磁共振谱图上峰值比为3:2:1。写出其中一种同分异构体的结构简式: 。
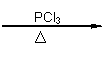 |
(5)已知:RCH2COOH RCHClCOOH;
 |
请以苯酚、乙醇为有机原料,制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
A.反应后溶液中无硝酸亚铁 B.反应前HNO3溶液的浓度为2.0mol
C.反应后溶液中c(NO3-)=1.6mol D.反应后的溶液最多还能溶解1.6lgFe
D.反应后的溶液最多还能溶解1.6lgFe
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和II均正确且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| C | SiO2与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| D | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com