
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(1)△H3=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
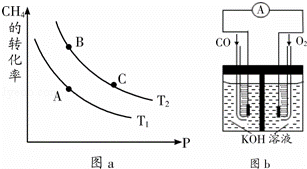
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则Tl T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为 .
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是 .
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=2.25.
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为
考点: 化学平衡的影响因素;用盖斯定律进行有关反应热的计算;化学平衡状态的判断;化学平衡的计算.
专题: 化学反应中的能量变化;化学平衡专题.
分析: (1)根据盖斯定律书写目标热化学方程式;
(2)①正反应为吸热反应,压强一定时,升高温度,平衡向正反应方向移动,甲烷的转化率增大,据此判断温度大小;
平衡常数只受温度影响,处于等温线上各点平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大;
②达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断;
利用三段式计算平衡时各组分的物质的量浓度,代入平衡常数表达式计算.
(3)CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根与水.
解答: 解:(1)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(1)△H3=﹣44.0kJ/mol
根据盖斯定律,①× ﹣②×
﹣②× +③×2得:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=﹣442.8 kJ•mol﹣1,
+③×2得:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=﹣442.8 kJ•mol﹣1,
故答案为:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=﹣442.8 kJ•mol﹣1;
(2)①由图开始,压强一定时,温度T2的转化率较大,正反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷的转化率增大,故温度Tl<T2;
平衡常数只受温度影响,B、C处于等温线上,平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大,比温度T1时的平衡常数大,故平衡常数KC=KB>KA,
故答案为:<;KC=KB>KA;
②a.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故a错误;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行,不能说明到达平衡,故b错误;
c.随反应进行混合气体总物质的量增大,容器容积不变,压强增大,当容器的压强恒定时,说明到达平衡,故c正确;
d.3v正(CH4)=v逆(H2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡,故d正确,
故答案为:cd;
平衡时甲烷的转化为0.5,则甲烷的浓度变化量=1mol/L×0.5=0.5mol/L,
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 1.5
平衡(mol/L):0.5 1.5 0.5 1.5
故平衡常数k= =2.25,
=2.25,
故答案为:cd;2.25;
(3)CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CO﹣2e﹣+4OH﹣=CO32﹣+2H2O,
故答案为:CO﹣2e﹣+4OH﹣=CO32﹣+2H2O.
点评: 本题比较综合,难度中等,涉及热化学方程式、化学平衡图象及影响因素、平衡常数、平衡状态判断、原电池等,(3)可以用总反应式减去正极电极反应式得负极电极反应式.


科目:高中化学 来源: 题型:
室温下将浓度相同的NaOH和HCl溶液以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为()
A. 0.01mol•L﹣1 B. 0.017mol•L﹣1 C. 0.05mol•L﹣1 D. 0.50mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9mol,这些气体恰好能被500ml 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为()
A. 0.2mol B. 0.4mol C. 0.8mol D. 0.9mol
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素.下列说法中不正确的是()
X Y
Z W
A. Z的原子半径大于Y
B. Y的非金属性强于W
C. W的氧化物对应的水化物都是强酸
D. X、Z的最高价氧化物均可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以下最接近阿伏伽德罗常数的是()
A. 2.0L 1.Omol•L﹣1 CH3COOH溶液中的H+离子数
B. 2.0L 1.0 mol•L﹣1CH3COONa溶液中的CH3COO﹣离子数
C. 1.0L 1.0 mol•L﹣1NaHCO3溶液中的HCO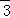 离子数
离子数
D. 1.0L 1.0 mol•L﹣1Na2CO3 溶液中的 C032﹣离子数
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42﹣)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为()
A. 0.2mol/L B. 0.25mol/L C. 0.45mol/L D. 0.225mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2几乎能与所有常见的气态非金属氧化物在一定条件下反应,如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:, .
(2)通过比较可知,当非金属元素处于 价态时,与Na2O2反应有O2生成.
(3)等物质的量的N2、O2、CO2的混合气体通过Na2O2后,体积变为原体积的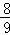 (同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
(同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为三种单质.已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物的水溶液中置换出来.由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y.
|
| A. | 只有① | B. | 只有②③ | C. | 只有①④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com