
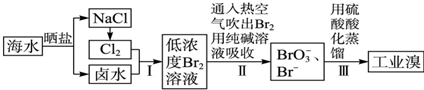
分析 海水晒盐得到氯化钠和卤水,电解氯化钠溶液或电解熔融氯化钠得到氯气,氯气通入卤水氧化溴离子为溴单质,得到低浓度的溴单质的溶液,通入热空气吹出溴蒸气,用纯碱溶液吸收后的溶液中加入硫酸酸化得到溴单质,起到富集溴的作用,最后得到工业溴.
(1)能用来萃取溴水中的溴,则选择与水不能互溶的有机溶剂,且与溴不能发生反应;
(2)溴单质具有易挥发性;
(3)根据反应物、生成物,结合转移电子守恒、原子守恒配平方程式;
(4)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸;强酸对设备的严重腐蚀;
(5)步骤Ⅰ中已获得游离态的溴浓度很低,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素;
(6)根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,溴比碘氧化性强.
解答 解:(1)萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应.
A.乙醇易溶于水,不能分层,不能做萃取剂,故A错误;
B.四氯化碳不溶于水,可以萃取溴单质,故B正确;
C.氢氧化钠能与溴反应,不能作萃取剂,故c错误;
D.苯是不溶于水比水轻的试剂,可以做萃取溴单质的萃取剂,故D正确;
故答案为:BD;
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用到溴的性质是易挥发;
故答案为:C;
(3)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为:3Br2+3CO32-═BrO3-+5Br-+3CO2↑,
故答案为:3;3;1;5;3;
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
(5)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本,
故答案为:富集(或浓缩)溴元素;
(6)单质溴能把碘离子氧化生成单质碘,根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,溴比碘氧化性强,反应的离子方程式为Br2+2I-═I2+2Br-,
故答案为:Br2+2I-═I2+2Br-.
点评 本题考查了海水资源的利用分析判断,主要是流程操作的理解应用,从整体上分析流程,明确每一步可能发生的反应及基本操作,再结合基本概念、基本理论是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
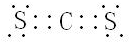 (用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;
(用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;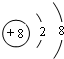 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
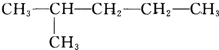 ⑥
⑥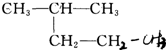
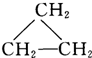
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物X2Y、ZY、ZX2中化学键的类型相同 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 由Y元素形成的离子与W元素形成的离子的电子数不可能相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com