
 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
分析 (1)3FeS2+8O2 $\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,只有O元素的化合价降低,利用化合价计算转移电子;
(2)氯化铁与铜发生氧化还原反应生成氯化铜和氯化亚铁;
(3)①首先加入H2O2,将亚铁离子氧化,调节pH使铁离子转化为沉淀,不能引入新杂质;
②检验所得所得滤液中杂质离子是否除尽,即检验是否含铁离子;
(4)酸性废水中抑制铁离子的水解;
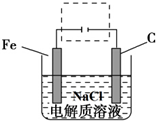
(5)外加电源即可制备氢氧化亚铁,Fe与电源正极相连,失去电子.
解答 解:(1)3FeS2+8O2 $\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,有3mol FeS2参加反应,8mol氧气参加反应,只有O元素的化合价降低,则转移电子为8mol×2×[0-(-2)]=32mol,
故答案为:32;
(2)氯化铁与铜发生氧化还原反应生成氯化铜和氯化亚铁,离子方程式为2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)①欲从废液中提取CuCl2,应首先加入H2O2,目的是将Fe2+转化为(或氧化为)Fe3+,然后选C或D调节pH,C或D可促进铁离子水解转化为沉淀,再过滤,浓缩结晶,
故答案为:将Fe2+转化为(或氧化为)Fe3+; CD;
②检验所得所得滤液中杂质离子是否除尽,即检验是否含铁离子,铁离子与SCN-结合生成络离子,与碱反应生成红褐色沉淀,与碘离子发生氧化还原反应,则ABCD均可,
故答案为:ABCD;
(4)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,离子反应为Fe3++3H2O?Fe(OH)3(胶体)+3H+,故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(5)外加电源即可制备氢氧化亚铁,Fe与电源正极相连,失去电子,如图为 ,电解反应为Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$ Fe(OH)2(胶体)+H2↑,
,电解反应为Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$ Fe(OH)2(胶体)+H2↑,
故答案为: 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$ Fe(OH)2(胶体)+H2↑.
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$ Fe(OH)2(胶体)+H2↑.
点评 本题考查金属单质及其化合物的性质,为高频考点,把握反应中元素的化合价变化及离子反应的书写及应用、电化学应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+═2Fe3++2H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | N2 | Cl2 | Br2 | I2 | O2 |
| 键能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 键长(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释后立即转移到容量瓶中 | |
| B. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| D. | 用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸氢钙溶液跟氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| C. | 氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | 亚硫酸钠和足量的稀硝酸混合:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com