
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、A、C、D的物质的量浓度相等 |
| B、混合气体的密度不再改变 |
| C、气体的总物质的量不再改变 |
| D、v(B)=2v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
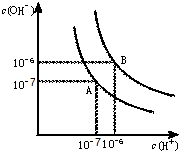 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:
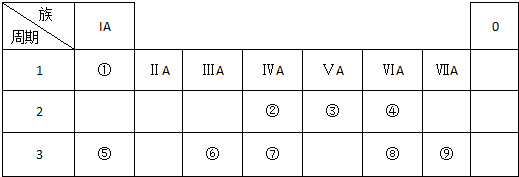
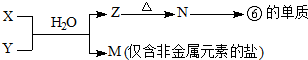
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com