
【题目】在容积为V的密闭容器中发生可逆反应![]() ?
?![]() ?
?![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.若A为气态,则气体的平均密度不再变化时反应达到平衡状态
B.升高温度,C的体积分数增大,则该反应正方向放热
C.达到平衡后,向容器中加入B,正反应速率一定增大
D.达到平衡后,若将容器的容积压缩为原来的一半,C的浓度变为原来的![]() 倍,则A一定为非气态
倍,则A一定为非气态
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)在催化剂表面发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),该反应仅在高温下能自发进行。
CO(g)+3H2(g),该反应仅在高温下能自发进行。
(1)该反应的 ΔH ____0(填“<” “>” 或 “=”)。
(2)T ℃时,向2L密闭容器中投入2mol CH4和1.5mol H2O(g),发生上述反应,平衡时CH4的转化率为50%,该温度下反应的平衡常数K=_____。
(3) T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,则反应的v(正)___v(逆) (选填“<” “>”或“=”)
(4)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,CO转化率最高的是容器______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:C(s)+H2O(g)===CO(g)+H2(g) △H=a kJ·mol-1; 2C(s)+O2(g)===2CO(g) ![]() H=-221 kJ·mol-1,H—H、O==O 和 O—H 键的键能分别为 436、498和486 kJ·mol-1,则a为 ( )
H=-221 kJ·mol-1,H—H、O==O 和 O—H 键的键能分别为 436、498和486 kJ·mol-1,则a为 ( )
A.+176.5B.-397.5C.+88.5D.-309.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )
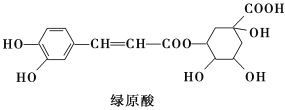
A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
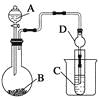
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的![]() 气体,且起始时体积相同.发生反应:2NO2(g)
气体,且起始时体积相同.发生反应:2NO2(g)![]() N2O4(g) △H<0,一段时间后相继达到平衡状态.下列说法中正确的是
N2O4(g) △H<0,一段时间后相继达到平衡状态.下列说法中正确的是

A.平衡时![]() 体积分数:甲
体积分数:甲 ![]() 乙
乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=c2(NO2)/( N2O4)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持恒温、恒容,在某密闭容器中发生反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ——从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ——从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ——从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ——从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两种途径从反应开始到平衡状态所消耗的时间相同
B.Ⅰ、Ⅱ两种途径最终达到平衡时,体系的总压强相等
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的物质的量分数相同
D.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.pH相等的四种溶液:![]()
![]()
![]()
![]() ,则四种溶液的溶质的物质的量浓度由小到大顺序为:
,则四种溶液的溶质的物质的量浓度由小到大顺序为:![]()
B.除去氯化铜溶液中的氯化铁杂质,可在溶液中加入过量的氧化铜,过滤达到除杂的目的
C.改变温度一定会导致已达化学平衡的反应发生移动
D.在一个固定容积的密闭容器中存在可逆反应![]() ,当混合气体的平均摩尔质量不再改变时,可逆反应一定达到平衡
,当混合气体的平均摩尔质量不再改变时,可逆反应一定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )

①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是4mL乙醇和12mL3mol/LH2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若a口出来的气体使溴水褪色,说明有乙烯生成
A.1B.2C.3D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com