
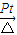 4NO+6H2O完成下列计算:
4NO+6H2O完成下列计算: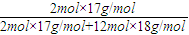 ×100%=13.6%
×100%=13.6%

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Pt | △ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| Pt |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气和氧气在催化剂存在下的反应方程式为4NH3![]() 5O2
5O2 ![]() 4NO
4NO![]() 6H2O完成下列计算:
6H2O完成下列计算:
(1)生成2molNO消耗氧气的体积为 L(标准状况)。
(2)10 mol NH3和10 molO2反应生成8 molNO,过量的氨溶于产物水中成为氨水,计算该氨水中氨的质量分数。
(3)经研究发现,氨氧化生成NO的同时也生成氮气:4NH3![]() 3O2 → 2N2
3O2 → 2N2![]() 6H2O
6H2O
若2 mol NH3和2molO2恰好完全反应,计算产物气体中NO的物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com