
�״�ȼ�Ϸ�Ϊ�״����ͺͼ״����͡���ҵ�Ϻϳɼ״��ķ����ܶࡣ
��1��һ�������·�����Ӧ��
CO2(g) +3H2(g) ��CH3OH(g)+H2O(g) ��H1
2CO (g) +O2(g) ��2CO2(g) ��H2
2H2(g)+O2(g) ��2H2O(g) ��H3
��CO(g) + 2H2(g)  CH3OH(g)���ġ�H�� ��
CH3OH(g)���ġ�H�� ��
��2�����ݻ�Ϊ2L���ܱ������н��з�Ӧ��CO(g)+2H2(g) CH3OH(g) �������������䣬��300���500��ʱ�����ʵ���n(CH3OH) �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����
CH3OH(g) �������������䣬��300���500��ʱ�����ʵ���n(CH3OH) �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����
��3����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��____________������ĸ����
| A����������� |
| B�������¶� |
| C�������¶� |
| D��ʹ�ú��ʵĴ��� |
 CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O(g)��5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���
CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O(g)��5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���
��1����H1+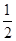 ��H2 ��
��H2 ��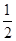 ��H3 ��2���� ��3��ABE ��4��6.75
��H3 ��2���� ��3��ABE ��4��6.75
��5����CH3OH + 3O2- -6e-= CO2+ 2H2O���ڼ״�����ȫ������������C��CO �� �������ת���ʴﲻ��100% ���������𰸶����� ��6����
���������������1�����ݸ�˹���ɼ��㣺�ܷ�ӦΪ��+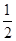 �ڣ�
�ڣ�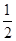 �ۣ��ܷ�Ӧ�ġ�Hͬ���仯��
�ۣ��ܷ�Ӧ�ġ�Hͬ���仯��
��2����300�浽500�棬n(CH3OH)��С��˵�����»�ѧƽ�������ƶ�����Ӧ�ġ�H��0��
��3����Ӧ�����������С�ķ��ȷ�Ӧ����״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��ѹ��С��������������¶ȣ����״��ӻ����ϵ�з�������ȷ���ʹ��Ӧƽ�������ƶ���
��4����Ӧ��ƽ�ⳣ��������������(1L���������ʵ����ʵ�����������Ũ��)��
CH4 + H2O CO + 3H2
CO + 3H2
ʼ�� 1 1 0 0
�䣺0.5 0.5 0.5 1.5
ƽ��0.5 0.5 0.5 1.5
K=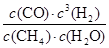 =
=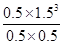 =6.75��
=6.75��
��5����B����CH3OH����ĸ����������ʹ�����O2-��Ӧ��ʧȥ��������CO2��H2O����ʵ�������ĵļ״��������������ϴ��ԭ��������ӷ�Ӧ���������״�û�вμ�ȫ����Ӧ����ת���̶��������״���̼Ԫ�ؿ��Ա仯Ϊ0��+2��+4�ۣ��������ɵ���̼��COʱת�Ƶĵ����٣�������ת����������ѧ�ܳ��˱�Ϊ���ܣ������������ܡ�
��6��̼��Ƶı�����Һ��c(Ca2+)=c(CO32-)=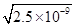 mol��L-1=5��10-5 mol��L-1��ϡ��1�����룻����Һ�������ز���Ӧ�����c(C2O42-)=4.0��10-4 mol��L-1����ʱc(Ca2+)��c(C2O42-)=4.0��10-4��2.5��10-5=1.0��10-8��4.0��10-8�������г�����
mol��L-1=5��10-5 mol��L-1��ϡ��1�����룻����Һ�������ز���Ӧ�����c(C2O42-)=4.0��10-4 mol��L-1����ʱc(Ca2+)��c(C2O42-)=4.0��10-4��2.5��10-5=1.0��10-8��4.0��10-8�������г�����
���㣺��ѧ��Ӧԭ���ۺϡ���ѧ��Ӧ�ȡ���Ӧ��ת��������ƽ�ⳣ�����㡢��������������Եļ��㡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������һЩ������ȼ����(kJ/mol)���ݣ��ش��������⣺
| ������ | ȼ���� | ������ | ȼ���� |
| ���� | 891��0 | ������ | 2 878��0 |
| ���� | 1560��8 | �춡�� | 2 869��6 |
| ���� | 2 221��5 | 2-������ | 3 531��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����β���е�NOx�Ǵ�����Ⱦ��֮һ����ѧ�����ڳ����ø���ѧ�ķ�����NOxת���������ʣ��Ӷ���������β����Ⱦ��
��1��ѹ����Ȼ����CNG���������ŵ�֮һ�����ô������ܹ���NOxת�������CO2��N2��
��CH4(g)��4NO2(g)  4NO(g)��CO2(g)��2H2O(g) ��H1��0
4NO(g)��CO2(g)��2H2O(g) ��H1��0
��CH4(g)��4NO(g) 2N2(g)��CO2(g)��2H2O(g) ��H2��0
2N2(g)��CO2(g)��2H2O(g) ��H2��0
��CH4(g) ��2NO2(g) N2(g) ��CO2(g) ��2H2O(g) ��H3�� �����á�H1�͡�H2��ʾ��
N2(g) ��CO2(g) ��2H2O(g) ��H3�� �����á�H1�͡�H2��ʾ��
��2���ں�ѹ�£���CH4(g)��NO2(g)�����ܱ������з�����ѧ��Ӧ�ۣ��ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��NO2��ƽ��ת���ʼ��±���
| Ͷ�ϱ�[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪H+(aq)+OH-(aq) H2O(l)����H="-57.3" kJ��mol-1,�ش��������⡣
H2O(l)����H="-57.3" kJ��mol-1,�ش��������⡣
(1)�ú�20 g NaOH��ϡ��Һ������ϡ���ᷴӦ�ų���������kJ��������
(2)�ú�2 mol H2SO4��ϡ��Һ������ϡNaOH��Ӧ,�˷�Ӧ���к���Ϊ��������������
(3)�����(1)��Ӧ�е�ϡ���ỻ��ϡ����,��Ӧ�ų���������������������(����ڡ���С�ڡ����ڡ�)ԭ��(1)�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ĺ�ҵ�ϳɹ��յij����ƶ������������Ľ���,���ٿƼ�������Ϊ��Ѱ�����۵İ����Ʊ�����,������ǰ����̵�̽���Թ�������ش����и���:
�������͵����ϳɰ���һ�����淴Ӧ,��ѧ����ʽ����:N2+3H2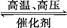 2NH3����֪,�ڳ�����,1 g H2��ȫת��ΪNH3,�ų�������Ϊ15.4 kJ��
2NH3����֪,�ڳ�����,1 g H2��ȫת��ΪNH3,�ų�������Ϊ15.4 kJ��
(1)��д���÷�Ӧ���Ȼ�ѧ����ʽ����
(2)���һ����Ӧ�Ħ�H-T��S<0,��÷�Ӧ�ܹ��Է����С���֪�÷�Ӧ�Ħ�S="-198.2" J��K-1��mol-1�������������ĺϳɷ�Ӧ�ڳ�������������(��ܡ����ܡ�)�Է����С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪���ƻ�1 mol N��N����H��H����N��H���ֱ���Ҫ���յ�����Ϊ946 kJ��436 kJ��391 kJ������1 mol N2(g)��3 mol H2(g)��ȫת��ΪNH3(g)�������仯����ֵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ժ������ʵ��о����������ż�Ϊ��Ҫ�����塣
��1��N2��O2��H2�֮����Է������Ϸ�Ӧ����֪��Ӧ���Ȼ�ѧ����ʽ���£�
N2(g)+O2(g)=2NO(g) 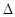 H=+180��5kJ��mol-1��
H=+180��5kJ��mol-1��
2H2(g)+O2(g)=2H2O(g) 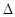 H =-483��6 kJ��mol-1��
H =-483��6 kJ��mol-1��
N2(g)+3H2(g)=2NH3(g) 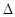 H =-92��4 kJ��mol-1��
H =-92��4 kJ��mol-1��
�Ĵ�������Ӧ���Ȼ�ѧ����ʽΪ ��
��2������β��������һ����Ӧԭ��Ϊ��2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) 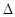 H<0��
H<0��
һ���¶��£���2��8mol NO��2��4mol COͨ��̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ����ʵ����仯��ͼ��ʾ��
��NO��ƽ��ת����Ϊ ��0~20minƽ����Ӧ����v(NO)Ϊ ��25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0��8 mol����ѧƽ�⽫ �ƶ�(����������ҡ�����)��
����ֻ�ı�ijһ��Ӧ����X����Ӧ��ԭƽ��I�ﵽ��ƽ��II������Y�ı仯��������ͼ��ʾ������˵����ȷ���� (����ĸ����)��
|
 ��3��ij��ѧС���������N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ�Ƴ�ȼ�ϵ�أ���õ�ص�������ӦʽΪ ������������Һ��������䣬����˵����ȷ���� (����ĸ����)��
��3��ij��ѧС���������N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ�Ƴ�ȼ�ϵ�أ���õ�ص�������ӦʽΪ ������������Һ��������䣬����˵����ȷ���� (����ĸ����)�� 1023�����ӣ����б�״����11��2L�缫��Ӧ�ﱻ����
1023�����ӣ����б�״����11��2L�缫��Ӧ�ﱻ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ԴΣ����ʹ�������Ѱ���µ������Դ�Ϳ�չ��������Դ����Ч���á��ļ����з������ȼ�ϵ��ʹ��������ֱ�Ӳ��������DZ����������ս�ԵĿ���֮һ���Զ��飨��֪�����ȼ����Ϊ2 877.6 kJ��mol��1��Ϊ�����ش��������⣺
��1��д������ȼ�յ��Ȼ�ѧ����ʽ��________________��
��2���������ȼ���ȣ�2 878 kJ��mol��1���춡���ȼ���ȣ�2 869 kJ��mol����������ת��Ϊ�춡��Ĺ�����________����ų��������ա���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2013���,�������������Ű�ҹ��ж�������������,����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
(1)����β����������Ҫԭ��Ϊ:2NO(g)+2CO(g)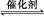 2CO2(g)+N2(g)�����ܱ������з����÷�Ӧʱ,c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯����,��ͼ��ʾ��
2CO2(g)+N2(g)�����ܱ������з����÷�Ӧʱ,c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯����,��ͼ��ʾ��
�ݴ��ж�:
�ٸ÷�Ӧ�Ħ�H����0(�>����<��)��
����T2�¶���,0��2 s�ڵ�ƽ����Ӧ����v(N2)=����������
�۵��������������һ��ʱ,���������������ѧ��Ӧ���ʡ��������ı����S1>S2,����ͼ�л���c(CO2)��T1��S2�����´ﵽƽ������еı仯���ߡ�
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н���,����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬������������(�����)�� 
(2)ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ���������������������,��CH4����ԭNOx�������������������Ⱦ��
����:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ��H1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ��H1="-867" kJ/mol
2NO2(g) N2O4(g) ��H2="-56.9" kJ/mol
N2O4(g) ��H2="-56.9" kJ/mol
д��CH4(g)����ԭN2O4(g)����N2(g)��H2O(g)���Ȼ�ѧ����ʽ:�� ��
�ڽ�ȼú�����Ķ�����̼��������,�ɴﵽ��̼�ŷŵ�Ŀ�ġ���ͼ��ͨ���˹��������,��CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦʽΪ�� �� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com