
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
分析 (1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是普通漏斗;
(2)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发,据此解答即可;
(3)根据平衡移动原理分析采用边反应边蒸出产物的原因;根据1-溴丁烷和正丁醇的沸点的沸点大小判断;
(4)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发;根据NaHSO3溶液具有还原性,溴单质具有氧化性回答;
(5)从有机混合物中获取有机物,可以采取蒸馏的方法;
(6)依据化学方程式分析1-丁醇、NaBr反应情况,依据化学方程式计算生成的1-溴丁烷质量,依据产率=$\frac{实际产量}{理论产量}$×100%计算得到.
解答 解:(1)溴乙烷和1-溴丁烷的制备实验中需要圆底烧瓶作反应器,产物需要蒸馏,需要量筒量取液体,而漏斗一般在过滤实验中需要,因此最不可能用到的仪器是漏斗,故选d,
故答案为:d;
(2)浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成;浓硫酸具有强氧化性能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成;反应需要溴化氢和1-丁醇反应,浓硫酸溶解溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发,
故答案为:减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质;
(3)根据题给信息知,乙醇和溴乙烷的沸点相差较大,采用边反应边蒸出产物的方法,可以使平衡向生成溴乙烷的方向移动,而1-溴丁烷和正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,所以不能边反应边蒸出产物,
故答案为:平衡向生成溴乙烷的方向移动(或提高乙醇的转化率,提高溴乙烷的产率等);1-溴丁烷的沸点和正丁醇相差较小,正丁醇会随1-溴丁烷同时蒸出;
(4)1-溴丁烷和水不能形成氢键所以不易溶于水,且密度大于水,所以将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层,溴单质和NaHSO3 溶液发生氧化还原反应,可以除去溴单质,
故答案为:下层;除去产物中杂质溴;
(5)溴乙烷和1-溴丁烷的沸点相差较大,可以采用蒸馏方法除去,
故答案为:蒸馏;
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,依据化学方程式计算判断反应情况:
CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O
74 103
7.4g 10.3g
溴化钠过量,则1-丁醇全部反应生成1-溴丁烷物质的量为0.1mol,质量=0.1mol×137g/mol=13.7g,
蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,产率=$\frac{9.6g}{13.7g}$×100%=70%,
故答案为:70%.
点评 本题主要考查了1-溴丁烷的制取实验,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握制备方案设计与评价原则,试题培养了学生的分析、理解能力及化学实验能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有氧化性的物质在反应中一定做氧化剂 | |
| B. | 氧化还原反应的实质是电子转移 | |
| C. | 某元素从游离态变为化合态,该元素一定被氧化 | |
| D. | 反应中当有一种元素被氧化时,一定有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
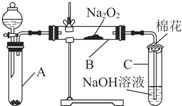 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 1 mol NO2和CO2的混合气体中含有的氧原子数为NA | |
| C. | 1.7g H2O2中含有的电子数为0.9NA | |
| D. | 1 mol Al3+离子含有的核外电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com