
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
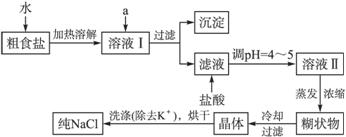
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、![]() 离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有______________(填仪器名称)。
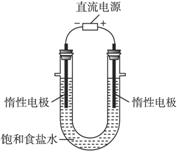
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2_______(填“>”“=”或“<”)2 L,原因是______________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为______________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:

(1)①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答NaOH不影响得分) ②75%乙醇
(2)天平、烧杯、500 mL容量瓶、胶头滴管
(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定
(4)e d
本题是一道综合性的实验题目,涉及了粗盐的提纯、一定物质的量浓度溶液的配制、电解饱和食盐水、氢气和氯气的实验制备,所涉及实验都是中学化学要求掌握的常见的重要实验。(1)①用NaOH溶液与Mg2+、Fe3+反应生成Mg(OH)2、Fe(OH)3而除去Mg2+、Fe3+;用BaCl2溶液与![]() 反应生成BaSO4而除去
反应生成BaSO4而除去![]() ,最后用饱和Na2CO3溶液除去Ca2+及后加入的Ba2+,NaOH溶液和BaCl2溶液的加入顺序可以颠倒,但Na2CO3溶液一定最后加入。②排除法,四氯化碳属于有机溶剂,KCl难溶于四氯化碳之中,故选用试剂为75%乙醇。(2)此题的解题技巧是根据一定物质的量浓度溶液配制实验的步骤进行。除了题中所提供的仪器外,还需要托盘天平、烧杯、500 mL容量瓶、胶头滴管。(3)由电解化学方程式为2NaCl+2H2O====2NaOH+Cl2↑+H2↑或电路中的电量守恒可知,V(H2)=V(Cl2)=2 L,但由于生成的氯气易与电解产物NaOH发生反应,故V(Cl2)<2 L。(4)选择制备并收集H2、Cl2的装置,应从它们的制备原理及气体的物理性质入手。实验室制取氢气不需要加热,故装置中不用酒精灯加热;又因氢气密度比空气小且难溶于水,故不宜采用向上排空气法收集而宜采用排水法收集,综合以上特点得出答案选e。制备并收集干燥、纯净Cl2的装置,由制取氯气的反应原理可知,制取氯气须加热,且制取过程中易产生杂质气体HCl,同时多余的氯气也有毒,因此须考虑除杂、尾气的吸收问题,故答案选d。
,最后用饱和Na2CO3溶液除去Ca2+及后加入的Ba2+,NaOH溶液和BaCl2溶液的加入顺序可以颠倒,但Na2CO3溶液一定最后加入。②排除法,四氯化碳属于有机溶剂,KCl难溶于四氯化碳之中,故选用试剂为75%乙醇。(2)此题的解题技巧是根据一定物质的量浓度溶液配制实验的步骤进行。除了题中所提供的仪器外,还需要托盘天平、烧杯、500 mL容量瓶、胶头滴管。(3)由电解化学方程式为2NaCl+2H2O====2NaOH+Cl2↑+H2↑或电路中的电量守恒可知,V(H2)=V(Cl2)=2 L,但由于生成的氯气易与电解产物NaOH发生反应,故V(Cl2)<2 L。(4)选择制备并收集H2、Cl2的装置,应从它们的制备原理及气体的物理性质入手。实验室制取氢气不需要加热,故装置中不用酒精灯加热;又因氢气密度比空气小且难溶于水,故不宜采用向上排空气法收集而宜采用排水法收集,综合以上特点得出答案选e。制备并收集干燥、纯净Cl2的装置,由制取氯气的反应原理可知,制取氯气须加热,且制取过程中易产生杂质气体HCl,同时多余的氯气也有毒,因此须考虑除杂、尾气的吸收问题,故答案选d。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)炸油条时1 kg面粉需加入0.5 kg水,4 g明矾和10 g小苏打及少量食盐等辅料,经烹炸,成品油条的产率一般为80%,通过计算说明若每天食用100 g油条,则摄入铝的量是__________________。?
(2)请列举我国国民在日常生活中摄入铝(除食品添加剂外)的三种可能途径。______________________________________________________________________?
查看答案和解析>>
科目:高中化学 来源:0115 月考题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com